
科目: 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:选择题
将V1ml1.0mol·L-1HCl溶液和V2ml未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+ V2=50ml)。下列叙述正确的是( )
V2=50ml)。下列叙述正确的是( )
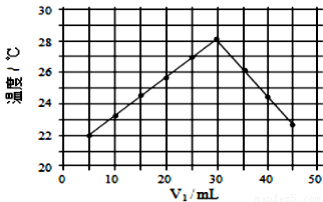
A. 做该实验时环境温度为22℃
B. 该实验表明热能可转化为化学能
C. NaOH溶液的浓度约为1.5mol·L-1
D. 该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:选择题
已知反应:2NO2(红棕色)  N204(无色) △H<0。将一定量的NO2充入注射器中后封口,右下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )
N204(无色) △H<0。将一定量的NO2充入注射器中后封口,右下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )

A.b点的操作是拉伸注射器
B.d点:v(正)>v(逆)
C.c点与a点相比,c(N02)增大,c(N204)减小,若容器绝热则平衡常数Ka>Kc
D.若不忽略体系温度变化,且没有能量损失,则T(b)<T(c)
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:选择题
把温度为20℃,浓度为1.0mol·L-1的H2SO4和2.2mol·L-1的碱溶液各50ml混合(溶液密度均为1g·ml-1,比热容为4.184kJ·K-1·kg-1),轻轻搅动。测得酸碱混合液的温度变化数据如下:
反应物 | 起始温度t1℃ | 终止温度t2℃ |
H2SO4+NaOH | 20 | 33.6 |
H2SO4+NH3·H2O | 20 | 32.6 |
则反应NH3·H2O=NH4++OH-的焓变约为( )(单位:kJ·mol-1)
A.2.1 B.4.2 C.52.7 D. 缺少数据无法计算
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:选择题
已知下列两个气态物质之间的反应:
C2H2(g)+H2(g) C2H4(g)①
C2H4(g)①
2CH4(g) C2H4(g)+2H2(g)②
C2H4(g)+2H2(g)②
已知在降低温度时①式平衡向右移动,②式平衡向左移动,则下列三个反应:
(Q1、Q2、Q3均为正值)
C(s)+2H2(g)=CH4(g)ΔH=-Q1
2C(s)+H2(g)=C2H2(g)ΔH=-Q2
2C(s)+2H2(g)=C2H4(g)ΔH=-Q3Q值大小比较正确的是( )
A. Q1>Q3>Q2 B. Q1>Q2>Q3 C. Q2>Q1>Q3 D. Q3>Q1>Q2
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:实验题
甲、乙两个小组利用酸性KMnO4与H2C2O4溶液反应,设计实验探究影响反应速率的因素(2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2+8H2O)
甲组:利用如图装置,通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小.(实验中所用KMnO4溶液均已加入H2SO4)

序号 | A溶液 | B溶液 |
① | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
② | 2ml 0.1mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液 |
③ | 2ml 0.2mol/LH2C2O4溶液 | 4ml 0.01mol/LKMnO4溶液和少量MnSO4 |
(1)该实验的目的是探究________________对化学反应速率的影响.
(2)分液漏斗中A溶液应该_____________加入(填“一次性”或“逐滴滴加”)
(3)实验结束后,读数前为了使两个量气管的压强相等,避免产生压强差,影响测定结果,需要进行的操作是____________________.
乙组:通过测定KMnO4溶液褪色所需时间的多少来比较化学反应速率为了探究KMnO4与H2C2O4浓度对反应速率的影响,某同学在室温下完成以下实验
实验编号 | 1 | 2 | 3 | 4 |
水/ml | 10 | 5 | 0 | X |
0.5mol/L H2C2O4/ml | 5 | 10 | 10 | 5 |
0.2mol/L KMnO4/ml | 5 | 5 | 10 | 10 |
时间/s | 40 | 20 | 10 | ﹣﹣﹣ |
(4)X=____________
A.5 B.10 C.15 D.20
4号实验中始终没有观察到溶液褪色,你认为可能的原因是____________
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:填空题
现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________移动(填“向左”、“向右”或“不”);另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中 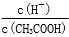 的比值将____________(填“增大”、“减小”或“无法确定”)。
的比值将____________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)___ _______pH(乙)(填“大于”、“小于”或“等于”,下同)。
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲)___________V(乙)。
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:填空题
空气中CO2的含量及有效利用,已经引起各国的普遍重视
Ⅰ:目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) 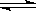 CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示.
CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol;测得CO2和CH3OH(g)的浓度随时间变化如图甲所示.
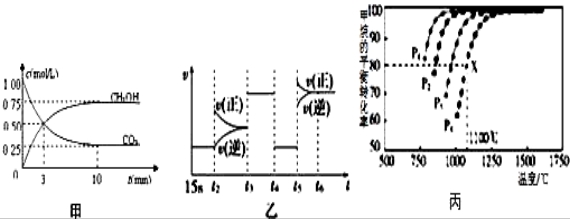
(1)前3min内,平均反应速率v(H2)=_________ _____.此温度下该反应的平衡常数为____________(保留两位小数).
(2)下列措施中,既能使反应加快,又能使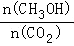 增大的是___________.
增大的是___________.
A.升高温度 B.充入惰性气体 C.将H2O(g)从体系中分离 D.再充入1mol H2
(3)图乙中t5时引起平衡移动的 条件是_____________.(填序号)
条件是_____________.(填序号)
A.升高温度 B.增大反应物浓度 C.使用催化剂 D.增大体系压强
(4)反应达到平衡后,若向反应体系再加入CO2(g)、H2(g)、CH3OH(g)、H2O(g)各1mol,化学平衡____________(填“正向”、“逆向”或“不”)移动.
Ⅱ:利用CO2(g)+CH4(g) 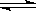 2CO(g)+2H2(g)将CO2转化成燃料气.T℃时,在恒容密闭容器中通入物质的量均为0.1mol的CH4与CO2,发生上述反应,测得CH4的平衡转化率与温度及压强的关系如图所示,
2CO(g)+2H2(g)将CO2转化成燃料气.T℃时,在恒容密闭容器中通入物质的量均为0.1mol的CH4与CO2,发生上述反应,测得CH4的平衡转化率与温度及压强的关系如图所示,
(5)下列事实能说明该反应达到平衡的是_______________
a.CO的物质的量不再发生变化
b.混合气体的密度不再发生变化
c.v正(CO2)=2v逆(H2)
d.混合气体压强不再发生变化
e.单位时间内生成n mol CH4的同时消耗2n mol H2
(6)据图可知P1、P2、P3、P4由小到大的顺序是__________________________.
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:填空题
合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:

(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:_______________。
(2)步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g) CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是 __。
利用反应②,将CO进一步转化,可提高H2的产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为____________。
(3)如图表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:______________。

(4)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)_____________。简述本流程中提高合成氨原料总转化率的方法:_________________。
查看答案和解析>>
科目: 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:实验题
用中和滴定的方法测定NaOH和Na2CO3的混合溶液中NaOH的含 量,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全转变成BaCO3沉淀,然后用标准盐酸滴定(已知几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10)。
量,可先在混合液中加入过量的BaCl2溶液,使Na2CO3完全转变成BaCO3沉淀,然后用标准盐酸滴定(已知几种酸碱指示剂变色的pH范围:①甲基橙3.1~4.4 ②甲基红4.4~6.2 ③酚酞8.2~10)。
(1)滴定时应选用  作指示剂;
作指示剂;
(2)判断到达滴定终点的实验现象是  。
。
(3)下列操作会导致烧碱样品中NaOH含量测定值偏高的是
A.锥形瓶用蒸馏水洗后未用待测液润洗
B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.在滴 定前有气泡,滴定后气泡消失
定前有气泡,滴定后气泡消失
D.滴定前平视读数,滴定结束俯视读数
(4)为测定某烧碱样品中NaOH的含量(设样品中杂质为Na2CO3),某同学进行如下实验:准确称取5.0g样品配制成250mL溶液,然后分三次各取配制好的烧碱溶液20.00mL于三个用蒸馏水洗净的锥形瓶中,分别加 入过量的BaCl2溶液,并向锥形瓶中各加入1~2滴指示剂,用浓度为0.2000mol·
入过量的BaCl2溶液,并向锥形瓶中各加入1~2滴指示剂,用浓度为0.2000mol· L-1的盐酸标准液进行滴定,相关数据记录如下:
L-1的盐酸标准液进行滴定,相关数据记录如下:
实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
初读数 | 末读数 | ||
1 | 20.00 | 0.80 | 21.00 |
2 | 20.00 | 1.00 | 20.80 |
3 | 20.00 | 0.20 | 22.80 |
依据表中数据,计算出烧碱样品中含NaOH的质量分数为 。(小数点后保留两位数字)
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 现象相同,沉淀量相等 | B. | 现象相同,沉淀量不等 | ||
| C. | 现象不同,沉淀量相等 | D. | 现象不同,沉淀量不等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com