
科目: 来源: 题型:解答题
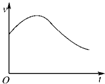 氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图所示,已知这个反应速率随着溶液中c(H+)增大而加快.
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图所示,已知这个反应速率随着溶液中c(H+)增大而加快.查看答案和解析>>
科目: 来源: 题型:选择题
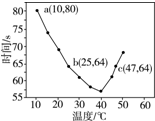
| A. | 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 | |
| B. | 图中b、c两点对应的NaHSO3的反应速率相等 | |
| C. | 图中a点对应的NaHSO3的反应速率为5.0×10-5 mol•(L•s)-1 | |
| D. | 温度高于40℃时,淀粉不宜用作该实验的指示剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 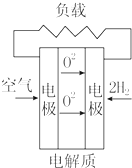 固体氧化物燃料电池 | B. | 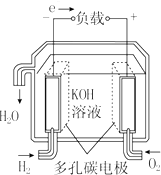 碱性燃料电池 | ||
| C. | 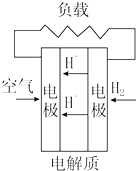 质子交换膜燃料电池 | D. | 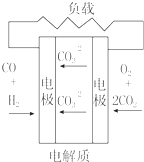 熔融盐燃料电池 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①⑤⑥⑨ | B. | ④⑥⑦⑧ | C. | ④⑥⑦⑨ | D. | ③④⑥⑦ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 油脂、乙酸乙酯都属于酯类,但不是同系物 | |
| B. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| C. | 分子式为C3H7Cl的同分异构体共有2种 | |
| D. | 谷氨酸分子(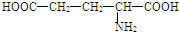 )间缩合可形成二肽 )间缩合可形成二肽 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 仅含有碳和氢两种元素的化合物称为烃 | |
| B. | 凡是分子里含碳元素的化合物都属于烃 | |
| C. | 甲烷可以使酸性高锰酸钾溶液褪色 | |
| D. | 有机化合物分子中碳原子之间只有单键 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
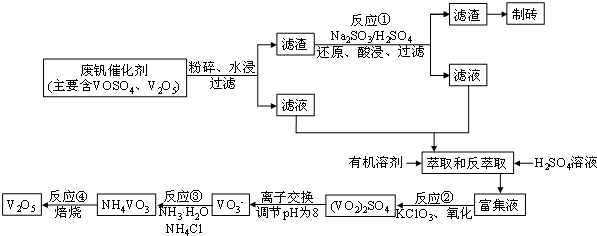
查看答案和解析>>
科目: 来源: 题型:多选题
| 选项 | 操作 | 现象 | 结论 |
| A | 将足量的乙烯通入到溴水中 | 溴水褪色 | 乙烯与溴水反应生成无色物质 |
| B | 往CaCl2溶液中通入足量的CO2 | 先有白色沉淀生成,后沉淀溶解 | CaCO3不溶于水,Ca(HCO3)2可溶于水 |
| C | 将铜板电路投入FeCl3溶液中 | 铜溶于FeCl3溶液 | 氧化性:Fe3+>Cu2+ |
| D | 取久置的Na2O2粉末,向其中滴加足量的盐酸 | 产生无色气体 | Na2O2已变质为Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 第一电离能:②>③>① | B. | 原子半径:③>②>① | ||
| C. | 电负性:①>②>③ | D. | 最高正化合价:③>②>① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com