
科目: 来源: 题型:解答题
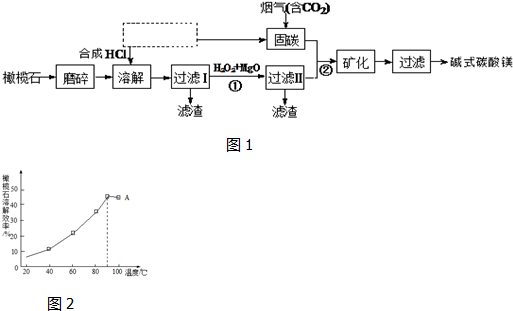
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
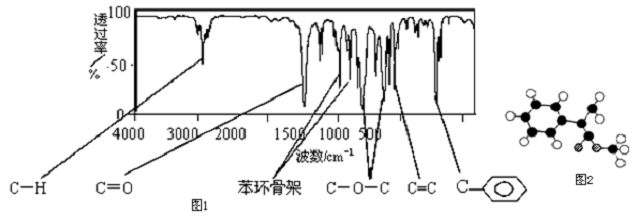
 (包括顺反异构)
(包括顺反异构)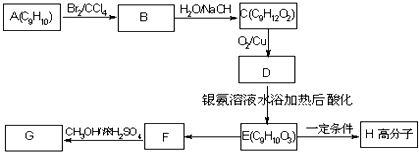
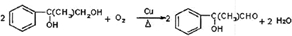
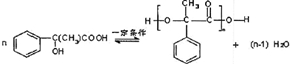
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )| A. | 第二份溶液中最终溶质为FeSO4 | |
| B. | OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 | |
| C. | 原混合酸中NO3- 物质的量为0.1 mol | |
| D. | H2SO4 浓度为2.5 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氢气的燃烧热为285.8kJ•mol-1,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 | |
| B. | 已知中和热为57.3 kJ•mol-1,若将1L1mol•L-1醋酸与含1molNaOH溶液混合,放出的热量要小于57.3kJ | |
| C. | Ba(OH)2•8H2O(s)+2NH4Cl(s)═BaCl2(s)+2NH3(g)+10H2O(l)△H<0 | |
| D. | 等质量的硫蒸气和硫黄分别完全燃烧,后者放出的热量多 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将等物质的量的KHC2O4和H2C2O4溶于水配成溶液:2c(K+)=c(HC2O4-)+c(H2C2O4) | |
| B. | pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小:①=②>③ | |
| C. | 0.1mol/LCH3COONa溶液与0.15 mol•L-1HCl等体积混合:c(Cl-)>c(H+)>c(Na+)>c(CH3COO-)>c(OH-) | |
| D. | 0.1 mol•L-1的KHA溶液,其pH=10,c(K+)>c(A2-)>c(HA-)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:解答题
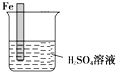 生活中我们常利用原电池装置对金属进行防护.请你在如图1的基础上设计一个原电池装置,阻止铁进一步与硫酸反应.
生活中我们常利用原电池装置对金属进行防护.请你在如图1的基础上设计一个原电池装置,阻止铁进一步与硫酸反应.查看答案和解析>>
科目: 来源: 题型:解答题
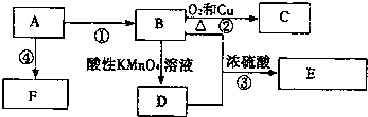
 ,F的结构简式
,F的结构简式 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.
;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com