15.某学习小组的同学在学习了Na
2CO
3、NaHCO
3的性质后,了解到它们都能与盐酸反应产生CO
2气体,那么如何鉴别Na
2CO
3和NaHCO
3呢?带着这样的疑问,他们进行了下列探究:
【猜想】(1)甲同学认为可用CaCl
2溶液鉴别Na
2CO
3和NaHCO
3溶液,而不能用澄清石灰水鉴别.
(2)乙同学认为固体Na
2CO
3、NaHCO
3可用加热的方法鉴别.依据是NaHCO
3不稳定,受热易分解,而Na
2CO
3受热不易分解.
(3)丙同学认为可用盐酸鉴别Na
2CO
3和NaHCO
3固体.
【实验探究】
(1)甲同学:①将CaCl
2溶液加入到分别盛有少量Na
2CO
3、NaHCO
3溶液的试管中,发现盛有Na
2CO
3的试管产生了白色沉淀;②将澄清石灰水加入到分别盛有少量Na
2CO
3、NaHCO
3溶液的试管中,发现两支试管中也都产生了白色沉淀.
此实验结果与猜想相同.
(2)乙同学分别取了一定量的Na
2CO
3、NaHCO
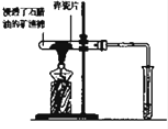
3固体于大试管中加热(如图):
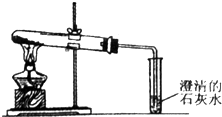
①加热Na
2CO
3时,开始即见小试管中有少量气泡产生,继续加热,气泡逐渐减少,未见澄清石灰水变浑浊,②加热NaHCO
3时,乙同学观察到实验现象与①不同,证实了自己的猜想是合理的.
(3)丙同学在两支分别盛有少量Na
2CO
3、NaHCO
3固体的试管中,各加入2mL
2mol/L的盐酸,观察到两支试管中均产生了大量气体,实验结果与猜想不一致,即得出不能用盐酸鉴别Na
2CO
3和NaHCO
3.
【问题讨论】
(1)甲同学的两个实验中,大家对CaCl
2与Na
2CO
3溶液的反应比较熟悉,该反应的离子方程式为CO
32-+Ca
2+=CaCO
3↓;
(2)乙同学在加热Na
2CO
3固体时,开始产生少量气泡的原因是空气受热膨胀;在加热NaHCO
3固体时,乙同学观察到的实验现象是澄清石灰水变浑浊、小试管中有大量气泡产生、大试管管口有水珠等.
(3)丁同学认为丙同学的结论不对.丁同学认为对实验方案做一些改进,可用于鉴别碳酸钠与碳酸氢钠.他的改进方法是:称取各2.1g 两种固体,放入两个容积一样的气球中,在两只锥形瓶中各加入约25mL 2mol/L 的盐酸,分别将气球套在锥形瓶瓶口上,同时将气球中的固体同时倒入锥形瓶中,气球的膨胀比较快(填快或慢)的或最后气球比较大(填大或小)的是碳酸氢钠.
【拓展应用】
(1)要除去Na
2CO
3溶液中混有的少量NaHCO
3,可加入适量的NaOH溶液.
(2)要测定Na
2CO
3与NaHCO
3固体混合物中Na
2CO
3的质量分数,可采用的方案有多种,请简述其中一种方案(写出简要步骤及要测定的数据,不要求写出如何用数据求出结果):方案一:称取5 g 样品于坩埚(已称量)加热至无水蒸气逸出,冷却、称 量加热后样品与坩埚的质量,重复至恒重;方案二:称取5 g 样品于已称质量的烧杯中,加入已称质量的50mL 2mol/L的硫酸,充分搅拌后,静置,称量烧杯(含反应后溶液)的质量至恒重;方案三:称取5 g 样品于已称质量的烧杯中,加入50mL 2mol/L的氢氧化钡溶液,充分搅拌后,静置,过滤、洗涤、烘干沉淀,冷却称量沉淀的质量;方案四:称取5 g 样品于烧杯中,加入50mL 蒸馏水,充分搅拌后,称量烧杯(含溶液)的质量,然后通入纯净干燥的二氧化碳,充分反应后,再称量至恒重.

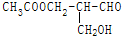 有光学活性,发生下列反应后生成的有机物无光学活性的是( )
有光学活性,发生下列反应后生成的有机物无光学活性的是( )

 .
.
 实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.