
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 75 mL 1 mol•L-1AlCl3溶液 | B. | 75 mL 0.5mol•L-1CaCl2溶液 | ||
| C. | 150 mL 1 mol•L-1 NaCl溶液 | D. | 150 mL 2 mol•L-1 KCl溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.3 mol/L的Na2SO4溶液中含有Na+和SO42-的总物质的量为0.9 mol | |
| B. | 当1 L水吸收标准状况下的22.4 L氯化氢时所得盐酸的浓度是1 mol/L | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 10℃时,0.35 mol/L的KCl饱和溶液100 mL蒸发掉5 g水,恢复到10℃时,它的物质的量浓度仍为0.35 mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 标签上给出的离子的物理量是物质的量浓度 | |
| B. | 任何饮用水中氯离子(Cl-)的浓度均在10~27.3 mg/L之内 | |
| C. | 该品牌饮用矿泉水中c(Mg2+)最大值为2×10-4mol/L | |
| D. | 一瓶该品牌饮用矿泉水中SO42-的物质的量不超过1×10-5mol |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 该硫酸的物质的量浓度为9.2mol/L | |
| B. | 1molZn与足量的该硫酸反应产生2g氢气 | |
| C. | 配制200mL4.6mol/L的稀硫酸需取该硫酸50 mL | |
| D. | 该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 酸性:HClO>H2SO4>H2CO3;非金属性Cl>S>C | |
| B. | 碱性:CsOH>KOH>Mg(OH)2>NaOH; 金属性:Cs>K>Mg>Na | |
| C. | 离子半径:Na+>Mg2+>Al3+>Cl-;原子半径:Na>Mg>Al>Cl | |
| D. | 稳定性:HF>H2O>NH3>CH4; 还原性:CH4>NH3>H2O>HF |
查看答案和解析>>
科目: 来源: 题型:解答题
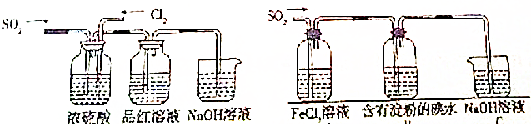
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 元素Z可与元素X形成共价化合物XZ2 | |
| B. | 元素X与W形成的原子个数比为1:1的化合物有很多种 | |
| C. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| D. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com