
科目: 来源: 题型:解答题
 近年来全国各地长期被雾霾笼罩,雾霾颗粒中汽车尾气占20%以上.已知汽车尾气中的主要污染物为NOx、CO、燃烧源超细颗粒(PM2.5)等由害物质.目前,已研究出了多种消除汽车尾气污染的方法.
近年来全国各地长期被雾霾笼罩,雾霾颗粒中汽车尾气占20%以上.已知汽车尾气中的主要污染物为NOx、CO、燃烧源超细颗粒(PM2.5)等由害物质.目前,已研究出了多种消除汽车尾气污染的方法.
| 实验编号 | 温度/°C | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
| 1 | 700 | 0.40 | 0.09 |
| 2 | 800 | 0.24 | 0.08 |
| 3 | 800 | 0.20 | a |
查看答案和解析>>
科目: 来源: 题型:解答题
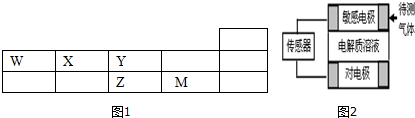

| 时间(min) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| X2 | 3.0 | n1 | 2.4 | n3 | n5 |
| H2 | 9.0 | 8.4 | 7.2 | n4 | n6 |
| XH3 | 0 | 0.4 | n2 | 2.0 | 2.0 |
查看答案和解析>>
科目: 来源: 题型:解答题
 ,判断下列物质不能与B发生化学反应的有C
,判断下列物质不能与B发生化学反应的有C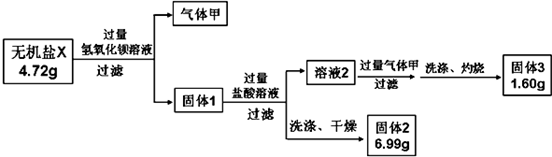
查看答案和解析>>
科目: 来源: 题型:解答题
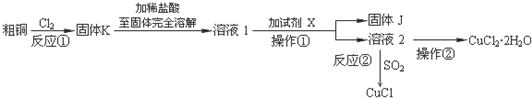
查看答案和解析>>
科目: 来源: 题型:解答题
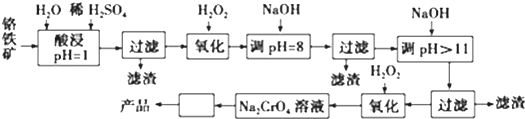
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.6 | 9.0 | -- | -- |
| 沉淀完全时的pH | 3.7 | 9.6 | 11.0 | 8 | 9(>9溶解) |
查看答案和解析>>
科目: 来源: 题型:解答题
 研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别占4%、18%.
研究人员通过对北京地区PM2.5的化学组成研究发现,汽车尾气和燃煤污染分别占4%、18%.| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.050 | 0.025 | 0.025 |
| 30 | 0.050 | 0.025 | 0.025 |
| 40 | 0.036 | 0.032 | 0.010 |
| 50 | 0.036 | 0.032 | 0.010 |
查看答案和解析>>
科目: 来源: 题型:解答题
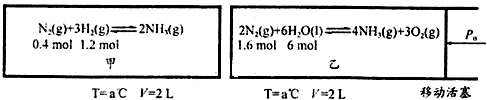
查看答案和解析>>
科目: 来源: 题型:解答题
 碳、氮的化合物在工农业生产中应用广泛.
碳、氮的化合物在工农业生产中应用广泛.| 序号 | 实验条件 | 反应时间 | CO(g)/mol | H2(g)/mol | CH3OH(g)/mol |
| 实验Ⅰ | 恒温恒容 | 0min | 2 | 4 | 0 |
| 10min | 2.8 | ||||
| 20min | 1 | ||||
| 实验Ⅱ | 绝热恒容 | 0min | 2 | 4 | 0 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 温度/℃ | 500 | 525 | 550 | 575 | 600 |
| 平衡转化率/% | 93.5 | 90.5 | 85.6 | 80.0 | 73.7 |
查看答案和解析>>
科目: 来源: 题型:解答题
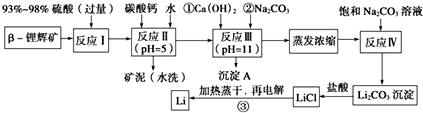
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com