
科目: 来源: 题型:解答题
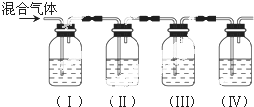
查看答案和解析>>
科目: 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
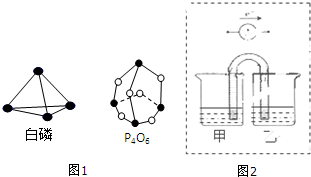
查看答案和解析>>
科目: 来源: 题型:填空题

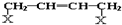
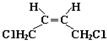

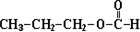 和
和 

 _
_查看答案和解析>>
科目: 来源: 题型:多选题
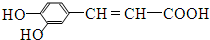 .下列有关咖啡酸的说法中,不正确的是( )
.下列有关咖啡酸的说法中,不正确的是( )| A. | 咖啡酸分子中的所有原子不可能共平面 | |
| B. | 咖啡酸可以发生还原、酯化、加聚、显色等反应 | |
| C. | 1mol咖啡酸可与4 mol Br2发生反应 | |
| D. | 1mol咖啡酸与NaOH溶液反应最多消耗1mol的NaOH |
查看答案和解析>>
科目: 来源: 题型:选择题
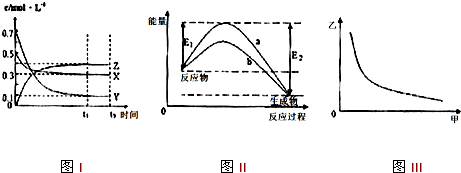
| A. | 该反应的化学方程式为X(g)+3Y(g)?2Z(g) | |
| B. | 图Ⅲ中甲表示压强,则纵坐标可表示混合气体中Z的含量或者混合气体的平均摩尔质量 | |
| C. | 若升高温度,该反应的平衡常数减小,Y的转化率降低 | |
| D. | 图Ⅱ中曲线可表示有无催化剂的能量变化曲线 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |

查看答案和解析>>
科目: 来源: 题型:解答题
| 实 验 内 容 | 实 验 试 剂 | 实 验 现 象 |
| 探究氧化性 | 取适量碘化钾淀粉溶液于试管中,加入过氧化氢溶液 | 溶液变蓝色 |
| 探究不稳定性 | 取适量过氧化氢溶液于试管中,加热, 用带火星的木条检验 | 产生气泡,木条复燃 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |

查看答案和解析>>
科目: 来源: 题型:填空题
 能源与资源是现代社会发展的重要支柱.
能源与资源是现代社会发展的重要支柱.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com