
科目: 来源: 题型:选择题
| A. | 淀粉、油脂、蛋白质都能水解,其产物均不相同 | |
| B. | 用高锰酸钾溶液除去混在乙炔中的少量乙烯 | |
| C. | 通过银镜反应可以区分甲醛和乙醛 | |
| D. |  用图所示实验装置制取交纯净的乙酸乙酯 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 明矾加入水中主要目的是悬浮杂质沉降 | |
| B. | 塑料、光导纤维、合成橡胶都属于有机高分子化合物 | |
| C. | 向含硫高的煤中加入石灰,可减少燃煤对大气的污染 | |
| D. | 利用二氧化碳等原料合成的聚二氧化碳可降解塑料有利于减少白色污染 |
查看答案和解析>>
科目: 来源: 题型:解答题

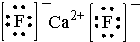 .则晶胞中与A离子距离相等且最近的E离子围成的几何体形状是正方体.
.则晶胞中与A离子距离相等且最近的E离子围成的几何体形状是正方体.查看答案和解析>>
科目: 来源: 题型:解答题
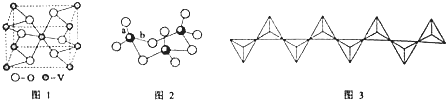
 .A的一种晶体的晶胞如图1甲,乙图中
.A的一种晶体的晶胞如图1甲,乙图中 和
和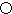 表示的是同种原子,即乙是8个甲无隙并置的结果,若按甲图中虚线方向切乙,得到图2的a~d,图中正确的是a.
表示的是同种原子,即乙是8个甲无隙并置的结果,若按甲图中虚线方向切乙,得到图2的a~d,图中正确的是a.
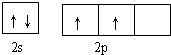 . 据报道,只含镁、C和D三种元素的晶体竟然具有超导性.该晶体的结构(如图3示)可看作由镁原子和C原子在一起进行面心立方密堆积,该晶体的化学式为MgCNi3.晶体中每个
. 据报道,只含镁、C和D三种元素的晶体竟然具有超导性.该晶体的结构(如图3示)可看作由镁原子和C原子在一起进行面心立方密堆积,该晶体的化学式为MgCNi3.晶体中每个 原子周围距离最近的
原子周围距离最近的 原子有12个.
原子有12个.查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 锌粒与稀H2SO4反应 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | 灼热的碳与CO2反应 | D. | 葡萄糖在人体内氧化 |
查看答案和解析>>
科目: 来源: 题型:解答题
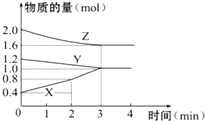 某温度时,在容积为3L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
某温度时,在容积为3L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
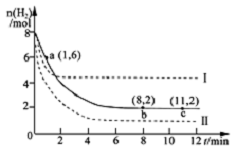 工业上可用CO2生产甲醇,反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).将6molCO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示.图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化.下列说法正确的是( )
工业上可用CO2生产甲醇,反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g).将6molCO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示.图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化.下列说法正确的是( )| A. | 反应开始至a点时v(H2)=2mol•L-1•min-1 | |
| B. | 若曲线I对应的条件改变是升高温度,则该反应△H>0 | |
| C. | 曲线II对应的条件改变是降低压强 | |
| D. | 保持温度不变,若将平衡后的容器体积缩小至1L,重新达平衡时则2 mol•L-1<c(CH3OH)<8/3 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com