
科目: 来源: 题型:解答题
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 2.4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 4.8 | 0 | 0 | t2 | 放出热量:Q | |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  验证铁钉发生吸氧腐蚀 | |
| B. | 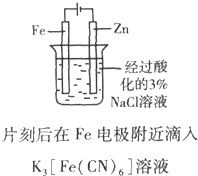 证明Fe电极被保护 | |
| C. | 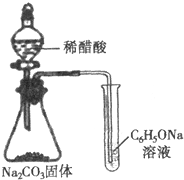 酸性强弱顺序为CH3COOH>H2CO3>C6H5OH | |
| D. | 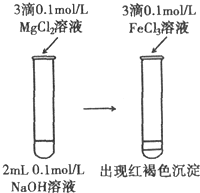 溶解度:Mg(OH)2>Fe(OH)3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ④ | B. | ①②④ | C. | ③④ | D. | ④⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 正极反应式为:O2+2H2O+4e-═4OH- | |
| B. | 该燃料电池的总反应方程式为:2H2+O2═2H2O | |
| C. | 工作一段时间后,电解液中的KOH的物质的量不变 | |
| D. | 工作时溶液中K+向负极移动 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 使电流通过电解质溶液而在阴、阳两极引起氧化还原反应,此过程中电能转化为化学能 | |
| B. | 一定条件下进行的化学反应,只能将化学能转化成光能或热能 | |
| C. | 需要加热才能进行的反应一定是吸热反应,放热反应不需要加热 | |
| D. | 将NaHCO3溶液蒸干后并加热至质量不发生变化,最终所得固体仍为NaHCO3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 正反应速率加大,逆反应速率减小,平衡向正反应方向移动 | |
| B. | 正反应速率减小,逆反应速率加大,平衡向逆反应方向移动 | |
| C. | 正反应速率和逆反应速率都减小,平衡向正反应方向移动 | |
| D. | 正反应速率和逆反应速率都减小,平衡向逆反应方向移动 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 回收其中的石墨电极 | |
| B. | 回收利用电池外壳的金属材料 | |
| C. | 不使电池中渗露的电解液腐蚀其他物品 | |
| D. | 防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 物质的状态与反应热有关 | B. | 物质的状态与生成物有关 | ||
| C. | 可以具体说明反应进行的情况 | D. | 可以具体说明反应发生的条件 |
查看答案和解析>>
科目: 来源: 题型:解答题
| N2 | O2 | Ar | CO2 |
| -196°C | -183°C | -186°C | -78°C |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com