
科目: 来源: 题型:选择题
| A. | 同一种核素 | B. | 互为同分异构体 | C. | 互为同素异形体 | D. | 互为同位素 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
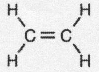 .
.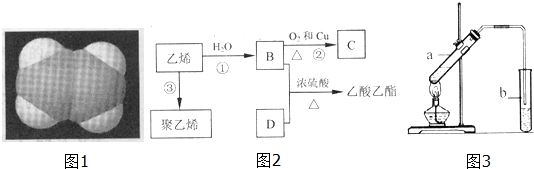
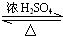 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
 .
.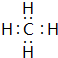 ,该化合物的二氯代物有1种.
,该化合物的二氯代物有1种.查看答案和解析>>
科目: 来源: 题型:解答题
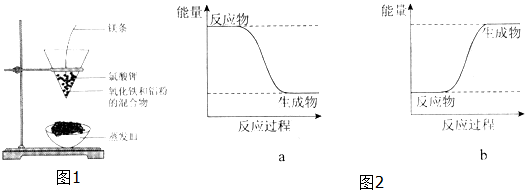
 Al2O3+2 Fe,其能量变化可用图2中的a(填“a”或“b”)表示.
Al2O3+2 Fe,其能量变化可用图2中的a(填“a”或“b”)表示.查看答案和解析>>
科目: 来源: 题型:解答题
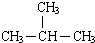 );
);查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电解饱和食盐水制备金属钠 | B. | 加热分解Ag2O制备金属银 | ||
| C. | Fe2O3与CO高温下反应制备金属铁 | D. | Cu2S与O2高温下反应制备金属铜 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO2+CH4$→_{△}^{催化剂}$CH3COOH | |
| B. | 2CO2+6H2$→_{△}^{催化剂}$C2H5OH十3H2O | |
| C. | 2CO2+6H2$→_{△}^{催化剂}$CH2=CH2+4H2O | |
| D. | 6CO2+6H2O$\stackrel{光照/叶绿素}{→}$C6H12O6+6O2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金属元素和非金属元素分界线附近的元素 | |
| B. | 右上方区域的非金属元素 | |
| C. | 过渡元素 | |
| D. | 稀有气体元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com