
科目: 来源: 题型:选择题
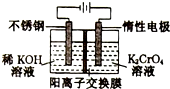
| A. | 电解过程中,K+由阴极室通过阳离子交换膜移阳极室 | |
| B. | 在阴极室,发生的电极反应为:2H++2e-═2H2↑ | |
| C. | 该电解过程实质是电解水 | |
| D. | 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为H+浓度增大,使平衡2CrO42-(黄色)+2H+?Cr2O32-(橙色)+H2O向右移动 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 化学式 | 电离常数 |
| HClO | Ki=3×10-8 |
| H2CO3 | Ki1=4.3×10-7 |
| Ki2=5.6×10-11 |
| A. | c(HC03-)>c(C10- )>c(OH-) | |
| B. | c(Na+)=c(C1O-)+c(HClO) | |
| C. | c(HClO)+c(ClO-)=c(HCO3 -)+c(H2CO3)+c(CO32-) | |
| D. | (Na+)+c(H+)=c(HCO3-)+c(ClO- )+c(OH-)+2 c(CO32-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| 容器编号 | 起始各物质的物质的量(mol) | 达到平衡时能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出23.15kJ能量 |
| ② | 0.9 | 2.7 | 0.2 | 放出QkJ能量 |
| A. | 容器①、②中反应的化学平衡常数相等 | |
| B. | 平衡时,两容器中氨的体积分数均约为14.3% | |
| C. | 反应②达到平衡时,放出的热量Q=23.15 kJ | |
| D. | 若①的体积为5.0 L,则达到平衡时放出的热量小于23.15 kJ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{a+b-2c}{4}$kJ | B. | $\frac{a+2b-4c}{8}$kJ | C. | $\frac{b-a-2c}{4}$kJ | D. | $\frac{2b-a-4c}{8}$kJ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | $\frac{2}{9}$ | B. | $\frac{2}{3}$ | C. | $\frac{1}{3}$ | D. | $\frac{1}{2}$ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SO2通入碘水中,反应的离子方程式为:SO2+I2+H2O═SO32-+2I-+2H+ | |
| B. | 加入铝粉能产生氢气的溶液中,可能存在大量的Na+、Ba2+、A102- N03 - | |
| C. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 | |
| D. | 25℃时NH4Cl溶液的KW大于100℃时NH4Cl溶液的KW |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 称取3g左右的干海带-托盘天平 | |
| B. | 过滤煮沸后的海带灰和水的混合物-漏斗 | |
| C. | 灼烧干海带至完全变成灰烬-蒸发皿 | |
| D. | 用四氯化碳从氧化后的海带灰浸取液中提取碘-分液漏斗 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | PM2.5含有的铅、镊、铬、钒、砷等对人体有害的元素均是金属元素 | |
| B. | 合成纤维和光导纤维都是有机高分子化合物 | |
| C. | 可以用SiN4、Al2O3,制作高温结构陶瓷制品 | |
| D. | 绿色化学的核心是应用化学原理对环境污染进行治理 |
查看答案和解析>>
科目: 来源: 题型:填空题
| 实验序号 | 0.1032mol/L HCI体积体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 25.00 |
| 2 | 26.53 | 25.00 |
| 3 | 27.85 | 25.00[来 |
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-) | |
| B. | c(HRO3-)+c(RO32-)+c(OH-)=c(H+)+c(Na+) | |
| C. | c(Na+)=c(HRO3-)+c(H2RO3)+c(RO32-) | |
| D. | 两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com