
科目: 来源: 题型:选择题
| A. | 相同 | B. | 中和HCl的多 | C. | 中和CH3COOH的多 | D. | 无法比较 |
查看答案和解析>>
科目: 来源: 题型:解答题
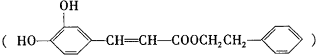 是一种天然抗癌药物,在一定条件下能发生如下转化
是一种天然抗癌药物,在一定条件下能发生如下转化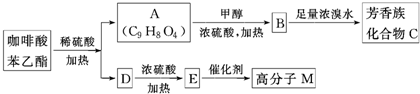
 ;
; ;
;查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
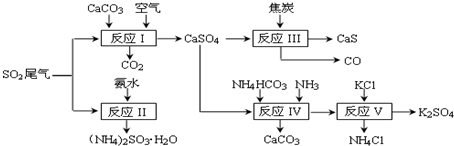
科目: 来源: 题型:解答题
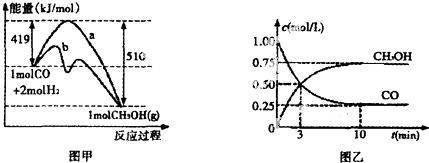
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向FeCl2溶液中滴加少量KSCN溶液变血红色,说明FeCl2完全被氧化成FeCl3 | |
| B. | 相同条件下,Na2CO3溶液的碱性强于C6H5ONa,说明C6H5OH的酸性强于H2CO3 | |
| C. | 向漂白粉上加入较浓的盐酸,产生的气体不能使湿润淀粉碘化钾试纸变蓝,说明该漂白粉已经失效 | |
| D. | 向浓度均为0.1 mol•L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3溶液,产生黄色沉淀,说明Ksp(AgCl)<Ksp(AgI) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 糖类、油脂和蛋白质都是人体必需的营养物质,都属于高分子化合物 | |
| B. | 除去乙醇中少量的乙酸:加入足量生石灰,蒸馏 | |
| C. | 乙醇和苯都不能使溴的四氯化碳溶液和酸性KMnO4溶液褪色 | |
| D. | 石油裂化的主要产品是甲烷、乙烯和苯 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
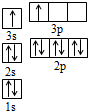 (1)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于水分子间存在氢键.
(1)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于水分子间存在氢键.| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com