
科目: 来源: 题型:解答题
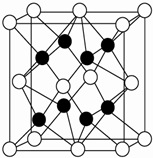 X、Y、Z、R、W均为周期表中前四周期的元素,其中原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质.
X、Y、Z、R、W均为周期表中前四周期的元素,其中原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质.查看答案和解析>>
科目: 来源: 题型:解答题
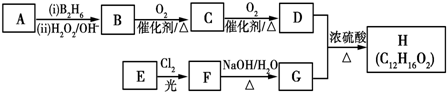
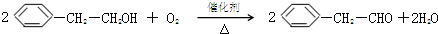 .
. .
.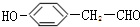 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
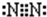 ;乙分子的结构式
;乙分子的结构式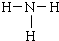 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | BaO2(过氧化钡)固体中的阳离子和阴离子 | |
| B. | ${\;}_{1}^{2}$H中的中子和质子 | |
| C. | NaHCO3中的阳离子和阴离子 | |
| D. | 4Be2+中的质子和电子 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | a>b | B. | a<b | C. | a=b | D. | 无法确定 |
查看答案和解析>>
科目: 来源: 题型:解答题
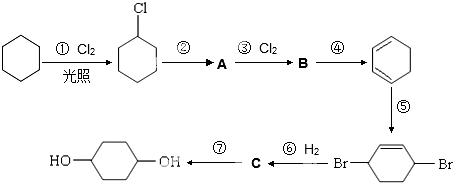
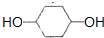
 ;
; .
.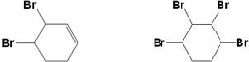 .
. +O2$→_{△}^{催化剂}$
+O2$→_{△}^{催化剂}$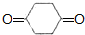 +2H2O.
+2H2O.查看答案和解析>>
科目: 来源: 题型:解答题
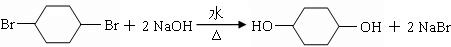
 +Br2→
+Br2→ ,反应类型为加成反应.
,反应类型为加成反应.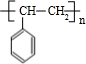 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com