
科目: 来源: 题型:填空题
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl-CO32- NO3- SO42- SiO32- |
查看答案和解析>>
科目: 来源: 题型:填空题
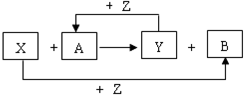 X、Y、Z为常见的三种单质,Z是绿色植物光合作用的产物之一,A、B为常见化合物.它们在一定条件下可发生如图所示的反应(均是在非溶液中进行的反应):
X、Y、Z为常见的三种单质,Z是绿色植物光合作用的产物之一,A、B为常见化合物.它们在一定条件下可发生如图所示的反应(均是在非溶液中进行的反应): ;
; 或
或 ;
;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 能使红色石蕊试纸变蓝的溶液中:Na+、K+、CO32-、NO3-、AlO2- | |
| B. | c(H+)=0.1 mol/L的溶液中:Cu2+、Al3+、SO42-、NO3- | |
| C. | 在加入铝粉后能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| D. | 含大量OH-的溶液中:CO32-、Cl-、F-、K+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(N2)﹕c(H2)﹕c(NH3)=1﹕3﹕2 | |
| B. | N2,H2和NH3的质量分数不再改变 | |
| C. | N2与H2的物质的量之和是NH3的物质的量的2倍 | |
| D. | 单位时间内每增加1mol N2,同时增加3mol H2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯胺水解产物最初为羟胺(NH2OH)和HCl | |
| B. | 氯胺在一定条件下可与乙烯加成得H2NCH2CH2Cl | |
| C. | 氯胺的消毒原理与漂白粉相似 | |
| D. | 氯胺的电子式为 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NaCl、FeCl3、Na2SO4、I2 | B. | NaCl、FeBr3、Na2SO4 | ||
| C. | NaCl、Fe2O3、Na2SO4 | D. | NaBr、FeCl3 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com