
科目: 来源: 题型:选择题
| A. | 用醋酸钠晶体和碱石灰共热制甲烷 | |
| B. | 将铁屑、溴水、苯混合制溴苯 | |
| C. | 在苯酚溶液中滴人少量稀溴水出现白色沉淀 | |
| D. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C3H8N4 | B. | C6H12N4 | C. | C6H10N4 | D. | C4H8N4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol氦气分子中含2NA个氦原子 | |
| B. | 25℃时,l L pH=13的Ba(OH)2 溶液中含有Ba2+的数目为0.1NA | |
| C. | 在标准状况下,22.4L空气中约有NA个气体分子 | |
| D. | 在0℃,101kPa时,22.4L氢气中含有NA个氢原子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  2,4-二硝基甲苯 2,4-二硝基甲苯 | B. | (CH3CH2)2CHCH33-甲基戊烷 | ||
| C. |  1,3-二甲基-2-丁烯 1,3-二甲基-2-丁烯 | D. |  异戊烷 异戊烷 |
查看答案和解析>>
科目: 来源: 题型:解答题
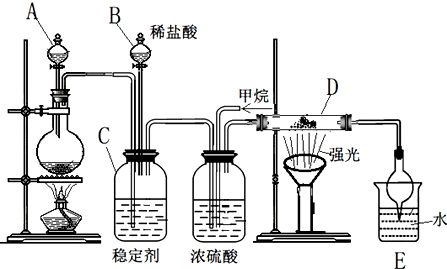
查看答案和解析>>
科目: 来源: 题型:解答题
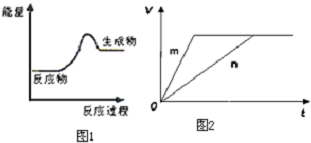
查看答案和解析>>
科目: 来源: 题型:解答题

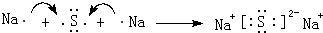 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 一定条件下达到化学平衡时,N2、H2和NH3的物质的量浓度之比为1:3:2 | |
| B. | 达到化学平衡时,N2完全转化为NH3 | |
| C. | 达到化学平衡时,正反应和逆反应速率相等,且都为零 | |
| D. | 单位时间内消耗a mol N2同时消耗2amol NH3,说明该反应已达到平衡状态 |
查看答案和解析>>
科目: 来源: 题型:解答题
 物质的结构决定性质,性质反映其结构特点.
物质的结构决定性质,性质反映其结构特点.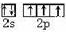 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 已知A、B、C、D均为前四周期元素且原子序数依次增大,元素A的基态原子2p轨道有3个未成对电子,元素B的原子最外层电子数是其内层电子数的3倍,元素C的一种常见单质为淡黄色粉末,D的内层轨道全部排满电子,且最外层电子数为l.
已知A、B、C、D均为前四周期元素且原子序数依次增大,元素A的基态原子2p轨道有3个未成对电子,元素B的原子最外层电子数是其内层电子数的3倍,元素C的一种常见单质为淡黄色粉末,D的内层轨道全部排满电子,且最外层电子数为l.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com