
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | SO2通入溴水中,溶液褪色 | 检验SO2的漂白性 |
| B | 向2mL淀粉溶液中加入稀硫酸,加热2min,加入新制Cu(OH)2在加热,无明显现象. | 淀粉在酸性条件下不水解 |
| C | 将制得的阿司匹林粗产品与饱和碳酸氢钠溶液充分反应后过滤 | 除去阿司匹林中的聚合物 |
| D | 等体积、pH同为3的酸A和B分别与足量的Zn反应,酸A放出的氢气多 | 酸性A比B强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
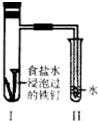
| A. | 过一段时间,Ⅱ试管中的导管内水柱上升 | |
| B. | Ⅰ试管中铁钉由于发生电解反应而被腐蚀 | |
| C. | 铁钉在该试管中的腐蚀速度越来越快 | |
| D. | Ⅰ试管中铁钉发生反应的一个电极方程式为:2Cl--2e-=Cl2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 只有① | B. | ①②③④的混合物 | C. | 只有② | D. | ①和③的混合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③④ | B. | ①③④⑤⑥ | C. | ①③⑥ | D. | ①②③④⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2O2是一种绿色氧化剂,可与酸性高锰酸钾作用产生 | |
| B. | 晶体硅具有半导体性质,可用于生产光导纤维 | |
| C. | 铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 | |
| D. | 铝具有良好的导电性,钢抗拉强度大,钢芯铝绞线可用作远距离高压输电线材料 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com