
科目: 来源: 题型:选择题
| A. | 乙醇(乙酸) 生石灰 过滤 | |
| B. | 溴乙烷(乙醇) 水 分液 | |
| C. | 乙醇(苯酚) NaOH溶液 分液 | |
| D. | 苯甲酸(苯甲酸钠) 硫酸 蒸馏 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 凡是含有碳元素的化合物都属于有机物 | |
| B. | 易溶于汽油、酒精、苯等有机溶剂中的物质,一定是有机物 | |
| C. | 所有的有机物都很容易燃烧 | |
| D. | 大多数有机物都是共价化合物 |
查看答案和解析>>
科目: 来源: 题型:解答题
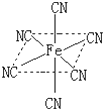 常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:
常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
查看答案和解析>>
科目: 来源: 题型:解答题
 ;由A、B、D三种元素组成的18电子微粒的电子式为
;由A、B、D三种元素组成的18电子微粒的电子式为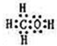
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | [Cr(H2O)6]Cl3 | B. | [Cr(H2O)4Cl2]Cl•2H2O | ||
| C. | [Cr(H2O)5Cl]Cl2•H2O | D. | [Cr(H2O)3Cl3]•3H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 78g苯分子中含有的碳碳双键数为3NA | |
| B. | 常温常压下,2g D216O中含中子数、质子数、电子数均为NA | |
| C. | 12g石墨烯(也就是单层石墨)中含有六元环的个数为NA | |
| D. | 7.8g Na2O2含有的阴离子数目为0.2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CBr2F2 | B. | CH3CH2OH | C. | CH3CH(OH)COOH | D. | CH3CH2CH3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 只有① | B. | ①③④ | C. | ②④⑥ | D. | 只有⑥ |
查看答案和解析>>
科目: 来源: 题型:解答题
 图中反应②的提示:C2H5OH+HO-NO2$→_{△}^{浓硫酸}$C2H5O-NO2+H2O
图中反应②的提示:C2H5OH+HO-NO2$→_{△}^{浓硫酸}$C2H5O-NO2+H2O (烃基可用R1、R2、R3表示).
(烃基可用R1、R2、R3表示). .
.查看答案和解析>>
科目: 来源: 题型:解答题
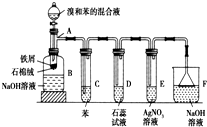 (1)苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑.
(1)苯和溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com