
科目: 来源: 题型:选择题
| A. | 托盘天平使用前应先调“零” | |
| B. | 容量瓶使用前应先检查是否漏水 | |
| C. | 分液漏斗使用前应先检验气密性 | |
| D. | 酒精灯在使用前应先检查灯芯是否有结焦现象 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
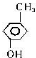 .
.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
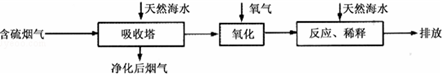
| 难溶 电解质 | AgI | AgOH | Ag2S | pbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 乙烯气相直接水合反应,在其他条件相同时,分别测得C2H4的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如图.结合曲线归纳平衡转化率
乙烯气相直接水合反应,在其他条件相同时,分别测得C2H4的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如图.结合曲线归纳平衡转化率查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com