
科目: 来源: 题型:选择题
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | 3v逆(C)=2v正(B) | D. | 气体的平均相对分子质量 |
查看答案和解析>>
科目: 来源: 题型:解答题
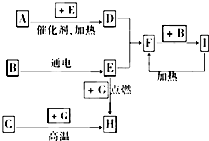 下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去,常温下,G为固体单质,B、I为液体,其余都为气体.A为化合物,I的浓溶液与G在加热条件下生成F、B和C. H可用作工业上冶炼金属的还原剂.请按要求填空:
下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去,常温下,G为固体单质,B、I为液体,其余都为气体.A为化合物,I的浓溶液与G在加热条件下生成F、B和C. H可用作工业上冶炼金属的还原剂.请按要求填空:查看答案和解析>>
科目: 来源: 题型:选择题
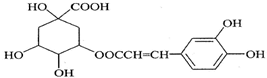
| A. | 分子式为C16H18O9 | |
| B. | 1 mol咖啡鞣酸水解时可消耗8molNaOH | |
| C. | 与苯环上碳直接相连的原子都在同一平面上 | |
| D. | 与浓溴水既能发生取代反应又能发生加成反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X2YZ4 | B. | XYZ3 | C. | X3YZ4 | D. | X4Y2Z7 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
查看答案和解析>>
科目: 来源: 题型:解答题
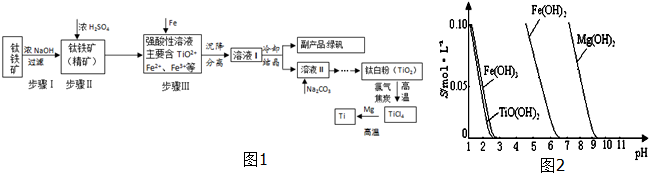
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 石油裂解得到的汽油是纯净物 | |
| B. | 煤的气化是物理变化 | |
| C. | 天然气是一种清洁的化石燃料 | |
| D. | 水煤气是通过煤的液化得到的气体燃料 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 矿石粉碎的目的是使原料充分利用,并增大接触面使反应速率加快 | |
| B. | 接触室中采用常压的主要原因是常压下SO2的转化率已经很高 | |
| C. | 沸腾炉中出来的混合气需要洗涤,目的是防止催化剂中毒 | |
| D. | 接触室采用450℃的温度是使催化剂活性最佳,提高平衡混和气中SO3的含量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | WX2分子中所有原子最外层都为8 电子结构 | |
| B. | WX2、ZX2的化学键类型相同 | |
| C. | WX2是以极性键结合成的分子 | |
| D. | 原子半径大小顺序为X<W<Y<Z |
查看答案和解析>>
科目: 来源: 题型:解答题

| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 完全沉淀的pH | 5.2 | 3.7 | 9.7 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com