
科目: 来源: 题型:解答题
| 元素 | 有关性质或结构信息 |
| A | 负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9% |
| B | B原子得到一个电子后3p轨道全充满 |
| C | C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X |
| D | D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物水化物的酸性为同主族最强 |
| E | E元素的核电荷数等于A原子的核电荷数和B元素氢化物的核电荷数之和 |
 ,写出该阳离子与硫的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
,写出该阳离子与硫的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.查看答案和解析>>
科目: 来源: 题型:解答题
 .
. ,该晶体中含微粒间的作用有:离子键和非极性键.
,该晶体中含微粒间的作用有:离子键和非极性键.查看答案和解析>>
科目: 来源: 题型:填空题
 元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.下图是元素周期表的一部分. .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目: 来源: 题型:选择题
| NaCl | MgCl2 | CaCl2 | SiCl4 | |
| 熔点(℃) | 801 | 712 | 782 | -68 |
| 沸点(℃) | 1 465 | 1 412 | 1 600 | 57.6 |
| A. | 仅① | B. | 仅② | C. | ①②④ | D. | ①②③ |
查看答案和解析>>
科目: 来源: 题型:解答题
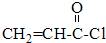 $→_{反应③}^{CH_{3}CH_{2}OH}$CH2=CH-COOCH2CH3
$→_{反应③}^{CH_{3}CH_{2}OH}$CH2=CH-COOCH2CH3 .(注明反应条件)
.(注明反应条件) 或CH2=CH-O-CH2-O-CH=CH2.
或CH2=CH-O-CH2-O-CH=CH2.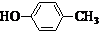 也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为
也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为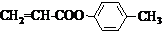 .
.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1句 | B. | 2句 | C. | 3句 | D. | 4句 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | XY2一定是分子晶体 | B. | XY2的电子式可能是 | ||
| C. | XY2水溶液不可能呈碱性 | D. | X可能是ⅣA、ⅤA或ⅥA族元素 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X与Y处于同一周期 | B. | 原子序数:a<b | ||
| C. | a-b=m+n | D. | 离子半径:Xn+>Ym- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com