
科目: 来源: 题型:选择题
| A. | CuSO4+2NaOH═Cu(OH)2↓+Na2SO4 | B. | Cl2+H2O?HCl+HClO | ||
| C. | Zn+H2SO4═ZnSO4+H2↑ | D. | 2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO |
查看答案和解析>>
科目: 来源: 题型:解答题
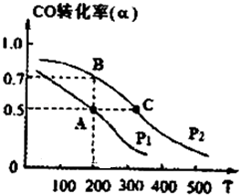 工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2 (g)?CH3OH (g)△H=-116kJ/mol
工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2 (g)?CH3OH (g)△H=-116kJ/mol查看答案和解析>>
科目: 来源: 题型:解答题
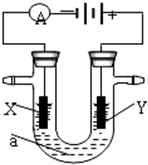 变”)
变”)查看答案和解析>>
科目: 来源: 题型:解答题
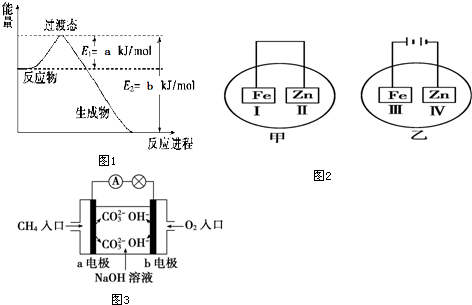
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 纯银奖牌久置后表面变暗 | |
| B. | 黄铜(Cu、Zn合金)制的铜锣不易产生铜绿 | |
| C. | 纯锌与稀硫酸反应时,滴少量硫酸铜溶液后速率加快 | |
| D. | 生铁比熟铁(几乎是纯铁)容易生绣 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)═2H2O(l)△H=-483.6 kJ•mol-1,则 2molH2(g)和1molO2(g)所含有的总能量比2mol H2O(l)所含有的总能量少483.6kJ | |
| B. | 己知2C(s)+2O2(g)═2CO2(g)△H12C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 | |
| C. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| D. | 利用盖斯定律可以间接计算通过实验难以测定反应的反应热 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 舱底镶嵌锌块,锌作负极,以防船体被腐蚀 | |
| B. | 在潮湿的中性环境中,金属的电化学腐蚀主要是析氢腐蚀 | |
| C. | 铁表面镀银,铁作阳极 | |
| D. | 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
查看答案和解析>>
科目: 来源: 题型:解答题
 ;取代反应;
;取代反应; ;取代反应;
;取代反应; ;加聚反应;
;加聚反应; CH3CH2OOCCOOCH2CH3+2H2O;酯化反应;
CH3CH2OOCCOOCH2CH3+2H2O;酯化反应;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO和CH3OH | B. | CO2和H20 | C. | H2和CO2 | D. | CH3OH和H2 |
查看答案和解析>>
科目: 来源: 题型:选择题
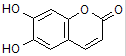
| A. | M的相对分子质量是180 | |
| B. | 1 mol M最多能与2 mol Br2发生反应 | |
| C. | M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 | |
| D. | 1 mol M与足量NaHCO3反应能生成2 mol CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com