
科目: 来源: 题型:选择题
| A. | 胶体区别于其他分散系的根本原因是胶体有丁达尔效应 | |
| B. | 氯化铁溶液加入到冷水中可以制得氢氧化铁胶体 | |
| C. | 分散系中分散质粒子直径由小到大的正确顺序是:溶液<胶体<浊液 | |
| D. | 胶体的分散质可以通过过滤从分散剂中分离出来 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 豆浆 | B. | NaCl溶液 | C. | HCl | D. | 空气 |
查看答案和解析>>
科目: 来源: 题型:解答题
 =CHCOOCH2CH3)的路线如下:
=CHCOOCH2CH3)的路线如下:



 )与化合物DCH3COOCH2CH3发生反应,可直接合成有机物Q.则D的结构简式为CH3COOCH2CH3,化合物C名称为苯甲醛.
)与化合物DCH3COOCH2CH3发生反应,可直接合成有机物Q.则D的结构简式为CH3COOCH2CH3,化合物C名称为苯甲醛.查看答案和解析>>
科目: 来源: 题型:解答题
 中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.查看答案和解析>>
科目: 来源: 题型:解答题
 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加.其中A元素原子的1s轨道上只有1个电子,B元素原子核外有三个未成对电子,B与C可形成离子化合物C3B2;D元素是地壳中含量最高的金属元素; E元素原子核外最外层只有1个电子,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加.其中A元素原子的1s轨道上只有1个电子,B元素原子核外有三个未成对电子,B与C可形成离子化合物C3B2;D元素是地壳中含量最高的金属元素; E元素原子核外最外层只有1个电子,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)查看答案和解析>>
科目: 来源: 题型:选择题
| A. | OHC-CH2-CH2COOCH3 | |
| B. |  | |
| C. |  | |
| D. |  |
查看答案和解析>>
科目: 来源: 题型:解答题
 ;
; ,请写出B元素的单质与氢氧化钠溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
,请写出B元素的单质与氢氧化钠溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | K+不一定存在 | B. | 100 mL溶液中含0.01 mol CO32- | ||
| C. | Cl-可能存在 | D. | Ba2+一定不存在,Mg2+可能存在 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 编号 | 实验操作 | 预期现象 | 结论 |
| ① | 用药匙取少许样品,加入试管A中,再用滴管取过量NaOH溶液并滴加到试管A中,充分反应后,静置,弃去上层清液,剩余固体备用 | 样品部分溶解,并有气体放出 | |
| ② | 往试管A的剩余固体中加过量稀硫酸,充分反应后,静置.取上层清液于试管B中,剩余固体备用 | 固体部分溶解,并有气体放出,溶液呈浅绿色 | 可能含铁 (填元素名称,以下同) |
| ③ | 往试管B中加入少许稀硝酸,再滴加KSCN溶液 | 溶液先变黄色,加KSCN后显血红色 | 结合②可知,一定含 |
| ④ | 往②剩余固体中加入稀硝酸,再滴加NaOH溶液 | 固体溶解,有无色刺激性气体产生并很快变成红棕色,溶液显蓝色,加NaOH溶液后有蓝色 沉淀产生. | 一定含铜. |
查看答案和解析>>
科目: 来源: 题型:解答题
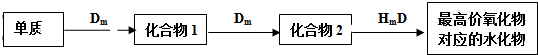
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com