
科目: 来源: 题型:选择题
| A. | 合成氨工厂通常采用20 MPa~50 MPa压强,以提高原料的利用率 | |
| B. | 合成氨工业中使反应温度达到500℃有利于氨的合成 | |
| C. | 合成三氧化硫过程中使用过量的氧气,以提高二氧化硫的转化率 | |
| D. | 阴暗处密封有利于氯水的储存 |
查看答案和解析>>
科目: 来源: 题型:解答题
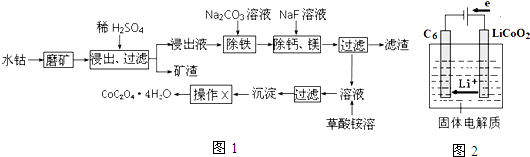
查看答案和解析>>
科目: 来源: 题型:解答题
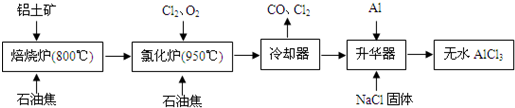
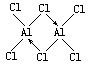 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2O2(l)═2H2O(g)+O2(g)△H=-196kJ•mol-1 | |
| B. | 在该反应中H2O2既做氧化剂.又做还原剂 | |
| C. | 反应速率与I-浓度有关 | |
| D. | v(H2O2)=v(H2O)=v(O2) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加人少量硫酸铜晶体 | B. | 不用稀硫酸而用浓硫酸 | ||
| C. | 用锌粉代替锌片 | D. | 加少量BaCl2晶体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 化学反应速率通常只能用反应物浓度的减少量表示 | |
| B. | 加入反应物可使反应速率增大 | |
| C. | 在研究反应速率变化的实验中.同时改变两个变量一定能更快得出有关规律 | |
| D. | 对于反应2H2O2═2H2O+O2↑.加入MnO2或升高温度都能加快O2的生成速率 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 燃料 | 一氧化碳 | 甲烷 | 异辛烷(C8H18) | 乙醇 |
| △H | -283.0kJ•mol-1 | -891.0kJ•mol-1 | -5461.0kJ•mol-1 | -1366.8kJ•mol-1 |
| A. | 一氧化碳 | B. | 甲烷 | C. | 异辛烷 | D. | 乙醇 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| 编号 | Ⅰ | Ⅱ | Ⅲ |
| 实验 |  |  |  |
| 现象 | 没有明显变化 | 有沉淀生成,溶液为蓝色 | 有无色气体放出 |
| A. | Ⅰ中无明显变化,说明两溶液无离子反应 | |
| B. | Ⅱ中的白色沉淀为CuCl2 | |
| C. | Ⅱ中生成的BaSO4沉淀不是电解质 | |
| D. | Ⅲ中的离子方程式为2H++Zn═Zn2++H2↑ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | K+、Ba2+、NO3-、SO42- | B. | K+、Na+、Cl-、ClO- | ||
| C. | Ca2+、NH4+、NO3-、Cl- | D. | K+、Na+、MnO4-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com