
科目: 来源: 题型:解答题
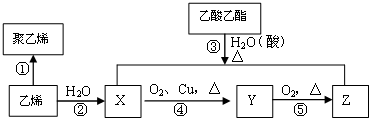
查看答案和解析>>
科目: 来源: 题型:解答题
 二甲醚(CH3OCH3)是一种重要的精细化工产品,被认为是二十一世纪最有潜力的燃料,已知:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(1)△H=-1455KJ/mol.工业上制备二甲醚的主要方法经历了三个阶段:
二甲醚(CH3OCH3)是一种重要的精细化工产品,被认为是二十一世纪最有潜力的燃料,已知:CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(1)△H=-1455KJ/mol.工业上制备二甲醚的主要方法经历了三个阶段:
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题


 .
. ,
, .
. .
. )发生酯化反应而生成的,写出F→G的反应的化学方程式CH2=C(CH3)COOCH2CH2OH+
)发生酯化反应而生成的,写出F→G的反应的化学方程式CH2=C(CH3)COOCH2CH2OH+ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +H2O.
+H2O.查看答案和解析>>
科目: 来源: 题型:解答题

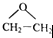 ,该反应的原子利用率为100%,其化学方程式为2CH2=CH2+O2$→_{△}^{Ag}$2
,该反应的原子利用率为100%,其化学方程式为2CH2=CH2+O2$→_{△}^{Ag}$2


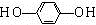 .
.查看答案和解析>>
科目: 来源: 题型:解答题
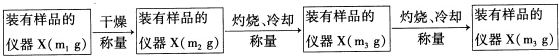
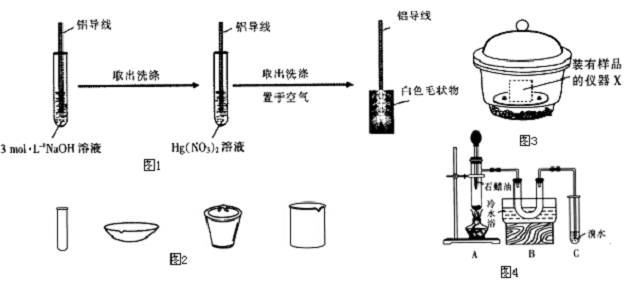
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该电池的工作环境是高温条件 | |
| B. | 作为负极的葡萄糖(C6H12O6)在变化中失去电子,被还原 | |
| C. | 该电池的电解质溶液是强酸性溶液,如浓硫酸或硝酸等 | |
| D. | 该电池的总反应为C6H12O6+6O2$\frac{\underline{\;催化剂\;}}{\;}$6CO2+6H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com