
科目: 来源: 题型:解答题
 已知A、B、C、D、E五种元素的原子序数依次增大,A元素位于周期表的s区,其原子中电子层数等于未成对电子数;B的基态原子中电子占据三种能量不同的原子轨道,且每种已知轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次增大,A元素位于周期表的s区,其原子中电子层数等于未成对电子数;B的基态原子中电子占据三种能量不同的原子轨道,且每种已知轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.查看答案和解析>>
科目: 来源: 题型:解答题

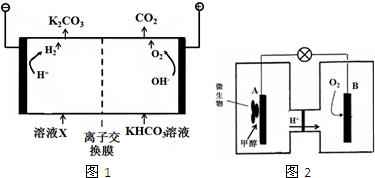
查看答案和解析>>
科目: 来源: 题型:解答题

 ,其反应方程式为
,其反应方程式为 (不要求标出反应条件).
(不要求标出反应条件). (不要求标出反应条件).
(不要求标出反应条件).查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
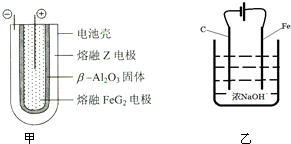 铝、铁是两种重要的金属元素,其单质及化合物在生产生活中的应用日趋广泛.
铝、铁是两种重要的金属元素,其单质及化合物在生产生活中的应用日趋广泛.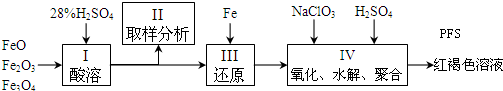
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氧化铝的熔点很低,不能用于制作耐高温材料 | |
| B. | 光化学烟雾与大量排放碳氢化合物和氮氧化合物有关 | |
| C. | 无水乙醇用作医用消毒剂效果更好 | |
| D. | Na、S、C分别在氧气中点燃均可得到两种不同的氧化物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 L水中含有1 mol MgCl2 | |
| B. | Cl-浓度为2 mol•L-1 | |
| C. | 溶液中含有1 mol MgCl2 | |
| D. | 将95 g MgCl2溶于1 L水中所得的溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com