
科目: 来源: 题型:选择题
| A. | ①②③ | B. | ②③ | C. | ①② | D. | ①③ |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cl2可以与KSCN溶液反应 | B. | (SCN)2可以与KI溶液反应 | ||
| C. | KSCN溶液可以与FeCl3溶液反应 | D. | (SCN)2可以与KBr溶液反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 金属钠着火时,可用泡沫灭火器来灭火 | |
| B. | Na2O2与水及CO2反应产生等量O2时,转移电子数相等 | |
| C. | 钠与熔融的四氯化钛反应可制取钛 | |
| D. | 不可用石灰水区分Na2CO3与NaHCO3溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
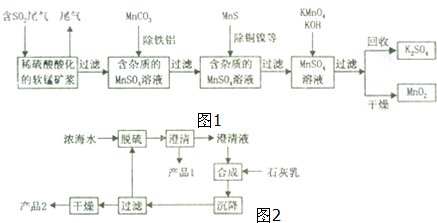
查看答案和解析>>
科目: 来源: 题型:解答题
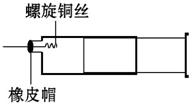 某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO.实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生.
某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO.实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生.查看答案和解析>>
科目: 来源: 题型:解答题
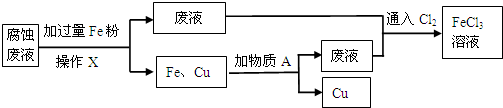
查看答案和解析>>
科目: 来源: 题型:解答题
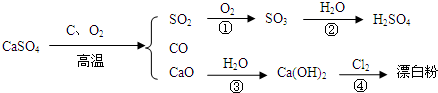
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cu+2H+═Cu2++H2↑ | B. | Na+H2O═Na++2OH-+H2↑ | ||
| C. | NH4++OH-═NH4OH | D. | CaCO3+2H+═Ca2++CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com