
科目: 来源: 题型:选择题
| A. | NH4+、H+、HCO3-、Cl- | B. | Fe3+、K+、CO32-、NO3- | ||
| C. | K+、Al3+、Cl-、OH- | D. | K+、Ba2+、NO3-、OH- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1076.7 kJ/mol | |
| B. | N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-1076.7 kJ/mol | |
| C. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7 kJ/mol | |
| D. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1059.3 kJ/mol |
查看答案和解析>>
科目: 来源: 题型:解答题
 ;.
;.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
| X | Y | ||
| Z | W | Q |
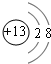 .
.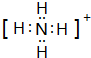 .
.查看答案和解析>>
科目: 来源: 题型:解答题
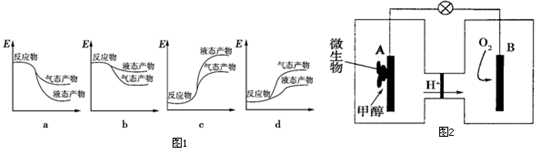
查看答案和解析>>
科目: 来源: 题型:选择题
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R<Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | T的氧化物既能与强酸反应又能与强碱反应 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 天然气的主要成分是甲烷 | |
| B. | 将固体燃料粉碎可以提高燃料的燃烧效率 | |
| C. | 废弃的镍镉电池如不回收,会严重污染环境 | |
| D. | 绿色化学的核心就是如何对被污染的环境进行无毒无害的治理 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若形成化学键释放的能量大于断裂化学键所吸收的能量,则是放热反应 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 由4P(s,红磷)═P4(s,白磷)△H=+139.2 kJ/mol,可知红磷比白磷稳定 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ 热量,氢气燃烧的热化学方程式可表示为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com