
科目: 来源: 题型:解答题
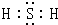 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度(mol•L-1) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol•L-1) | c1 | c2 | 0.4 |
| A. | 若升高温度,反应的平衡常数减小,则正反应为吸热反应 | |
| B. | 反应5 min内,v(PCl3)=0.08 mol•L-1•min-1 | |
| C. | 当容器中为1.2 mol Cl2时,可逆反应达到平衡状态 | |
| D. | 平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | O2和O3互为同素异形体 | B. | 1H、2H和3H互为同位素 | ||
| C. | CH2═CH2和 互为同系物 互为同系物 | D. |  和 和 互为同分异构体 互为同分异构体 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | +4、-2 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.102 | 0.110 | 0.143 | 0.160 | 0.186 |
 ,其中所含的化学键类型为离子键和非极性键.
,其中所含的化学键类型为离子键和非极性键.查看答案和解析>>
科目: 来源: 题型:解答题
 将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见氧化物,气体E是单质F所含元素的氢化物.
将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见氧化物,气体E是单质F所含元素的氢化物.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cd | B. | NiO(OH) | C. | Cd(OH)2 | D. | Ni(OH)2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 正极附近的 SO42- 离子浓度逐渐增大 | |
| B. | 电流由锌片流向铜片 | |
| C. | 溶液的pH逐渐变小 | |
| D. | 铜片上析出氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com