
科目: 来源: 题型:填空题
查看答案和解析>>
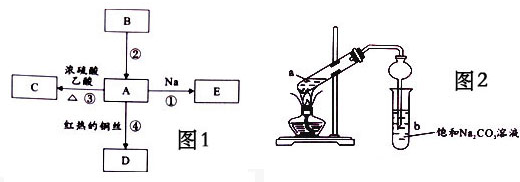
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3mo/L | B. | 1.5mo/L | C. | 2mo/L | D. | 4mo/L |
查看答案和解析>>
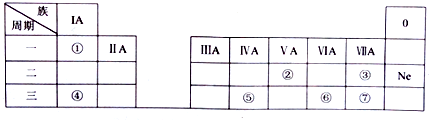
科目: 来源: 题型:选择题
 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示,已知Y原子的最外层电子数是K层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示,已知Y原子的最外层电子数是K层电子数的3倍,下列说法正确的是( )| A. | X与Y只形成一种化合物 | |
| B. | 单质Z溶于热的NaOH,生成Na2SO3和另一种盐,若转移电子数为2NA,则参加反应单质Z的质量为64g | |
| C. | XW3与H2O发生非氧化还原反应,只生成两种物质,其中一种为XH3,则另一种物质为HWO | |
| D. | ZY2气体通入BaCI2溶液中有白色沉淀生成 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应物的总能量一定低于生成物的总能量 | |
| B. | 所有的中和反应都为放热反应 | |
| C. | 破坏反应物中的化学键所吸收的总能量大于形成生成物中化学键所放出的总能量 | |
| D. | 放热反应,不必加热就可发生 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1.0 L 1.0 mol•L-1的NaClO水溶液中含有的氧原子数为NA | |
| B. | 总质量为a g的CO和N2的混合物中所含原子总数为$\frac{a{N}_{A}}{14}$ | |
| C. | 2.24 L的2H35Cl分子中的中子数是1.9NA | |
| D. | 某密闭容器中盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,形成N-H键的数目为0.6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com