
科目: 来源: 题型:选择题
| A. | 1.2mol•L-1•min-1 | B. | 2mol•L-1•min-1 | ||
| C. | 5mol•L-1•min-1 | D. | 10mol•L-1•min-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 | 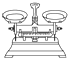 | 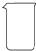 |  |  |  |  |
| 序号 | a | b | c | d | e | f |
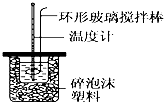
| 温度 实验次数 | 起始温度t1/℃ | 终止温 度t2/℃ | 平均温度差 (t2-t1)/℃ | ||
| H2SO4溶液 | NaOH溶液 | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 请填写(4.0℃ ) |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目: 来源: 题型:选择题
 已知A、B、C为中学化学中常见的单质,室温下A为固体,B和C均为气体.在适宜的条件下,它们可以按如图框图进行反应.下列说法正确的是( )
已知A、B、C为中学化学中常见的单质,室温下A为固体,B和C均为气体.在适宜的条件下,它们可以按如图框图进行反应.下列说法正确的是( )| A. | A、B、C中三种元素的任意两种元素形成的化合物所属物质类别可能是氧化物 | |
| B. | A、B、C中有一种金属且为B | |
| C. | 如果E溶液是一种强酸,则E溶液为硫酸 | |
| D. | A、B、C中三种元素的任意两种元素形成的化合物所属物质类别一定不是碱 |
查看答案和解析>>
科目: 来源: 题型:解答题
 ,结构简式H2C=CH2.
,结构简式H2C=CH2.查看答案和解析>>
科目: 来源: 题型:填空题
 (1)甲醇可为燃料电池的原料.以CH4和H2O为原料,通过下列反应制备甲醇.
(1)甲醇可为燃料电池的原料.以CH4和H2O为原料,通过下列反应制备甲醇.查看答案和解析>>
科目: 来源: 题型:解答题

 X的化学式为Fe3C,P中气体的化学式为CO2、NO2.
X的化学式为Fe3C,P中气体的化学式为CO2、NO2.查看答案和解析>>
科目: 来源: 题型:解答题
 .B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如下所示.
.B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如下所示.
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 甲烷与氯气混合后光照反应;乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯与溴的四氯化碳溶液反应;苯与氢气在一定条件下反应生成环己烷 | |
| C. | 苯与浓硝酸和浓硫酸的混合液反应生成油状液体;乙烯与水生成乙醇的反应 | |
| D. | 在苯中滴入溴水,溴水褪色;乙烯与溴水反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com