
科目: 来源: 题型:选择题
| A. | 144.0 g CuSO4 | B. | 144.0 g CuSO4•5H2O | ||
| C. | 225.0 g CuSO4•5H2O | D. | 250.0 g CuSO4•5H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该反应说明钠是强还原剂,可用于冶炼金属 | |
| B. | 该反应条件是TiCl4在熔融状态或水溶液中 | |
| C. | Ti是氧化产物 | |
| D. | TiCl4是还原剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②③④⑤ | B. | ④⑤⑦ | C. | ①③④⑤ | D. | ④⑤⑥⑦ |
查看答案和解析>>
科目: 来源: 题型:选择题
 在一定条件下,NO2(g)+CO(g)═NO(g)+CO2(g)反应过程的能量变化如图所示.下列说法错误的是( )
在一定条件下,NO2(g)+CO(g)═NO(g)+CO2(g)反应过程的能量变化如图所示.下列说法错误的是( )| A. | 该反应是放热反应 | |
| B. | 该反应的反应热△H=-234 kJ/mol | |
| C. | 加入催化剂,使该反应的活化能降低,反应速率加快,同时使该反应的反应热数值减小 | |
| D. | 由图可推出:NO(g)+CO2(g)=NO2(g)+CO(g)△H=+234 kJ/mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2SO4═2H++SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | KClO3═K++Cl-+3O2- | D. | NaHSO4═Na++HSO4- |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
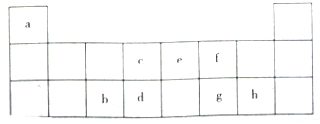 如该表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题:
如该表是元素周期表的短周期部分,表中字母分别表示一种元素.请回答下列问题: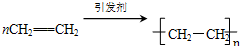 ;
;查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com