
科目: 来源: 题型:选择题
 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )| A. | 溶液中的阳离子只有H+、Mg2+、Al3+ | |
| B. | 溶液中n(NH4+)=0.1mol | |
| C. | 溶液中一定不含CO32-,可能含有SO42-和NO3- | |
| D. | n(H+):n(Al3+):n(Mg2+)=2:2:1 |
查看答案和解析>>
科目: 来源: 题型:解答题
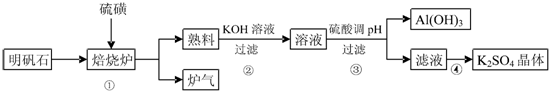
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 双氧水可用于皮肤伤口消毒 | |
| B. | 水玻璃是制备硅胶和木材防火剂等的原料 | |
| C. | 生石灰和铁粉都是食品包装中常用的干燥剂 | |
| D. | 生活中可用电解饱和食盐水的方法制取消毒液 |
查看答案和解析>>
科目: 来源: 题型:解答题
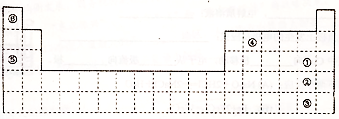
查看答案和解析>>
科目: 来源: 题型:选择题
 +HNO3$→_{55℃~60℃}^{浓H_{2}SO_{4}}$
+HNO3$→_{55℃~60℃}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.| A. | 仅③ | B. | 仅①③ | C. | 仅①③④ | D. | 全部 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2S、H2O、HF的稳定性依次增强 | |
| B. | RbOH、KOH、Mg(OH)2的碱性依次减弱 | |
| C. | Na+、Mg2+、Al3+的氧化性依次减弱 | |
| D. | H2SiO3、H2CO3、H2SO4 酸性依次增强 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
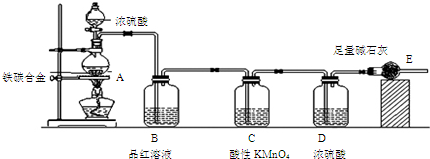
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com