
科目: 来源: 题型:选择题
| A. | 煤中含有苯及苯的同系物,可以通过干馏得到 | |
| B. | 煤是由有机物和无机物组成的复杂的混合物 | |
| C. | 含C18以上的烷烃经过催化裂化可以得到汽油 | |
| D. | 石油含有C5~C11的烷烃,可通过分馏得到汽油 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 某温度下的溶液中,c (H+)=10x mol/L,c (OH-)=10y mol/L.
某温度下的溶液中,c (H+)=10x mol/L,c (OH-)=10y mol/L.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 稀释溶液,溶液pH增大 | B. | 通入CO2,平衡朝正反应方向移动 | ||
| C. | 升高温度,$\frac{{c(HC{O_3}^-)}}{{c(C{O_3}^{2-})}}$减小 | D. | 加入NaOH固体,溶液pH减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 10 mL | B. | 5 mL | C. | 大于5mL | D. | 小于5mL |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 均存在电离平衡和水解平衡 | |
| B. | 分别加入NaOH固体,恢复至原温,c(CO32-)均增大 | |
| C. | c(OH-)前者大于后者 | |
| D. | 存在的粒子种类相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | C(Cl-)>C(NH4+)>C(H+)>C(OH-) | B. | C(Cl-)>C(NH4+)>C(OH-)>C(H+) | ||
| C. | C(Cl-)=C(NH4+)>C(H+)=C(OH-) | D. | C(NH4+)=C(Cl-)>C(H+)>C(OH-) |
查看答案和解析>>
科目: 来源: 题型:解答题
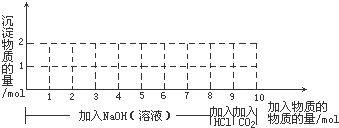
查看答案和解析>>
科目: 来源: 题型:解答题
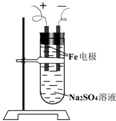 如图所示是用铁作电极,Na2SO4溶液作电解液,制备Fe(OH)2的改进装置.由于阴极产生的H2是还原性气体并且阻止了空气中的氧气进入溶液,所以,可以较长时间地保留Fe(OH)2白色絮状沉淀不变.请写出有关电极反应式:
如图所示是用铁作电极,Na2SO4溶液作电解液,制备Fe(OH)2的改进装置.由于阴极产生的H2是还原性气体并且阻止了空气中的氧气进入溶液,所以,可以较长时间地保留Fe(OH)2白色絮状沉淀不变.请写出有关电极反应式:查看答案和解析>>
科目: 来源: 题型:解答题
 已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略).已知:
已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略).已知:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com