
科目: 来源: 题型:解答题
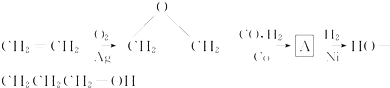
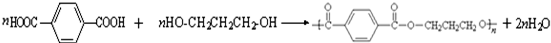 .
.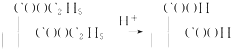 ,请你设计出合理的反应流程图.
,请你设计出合理的反应流程图.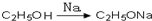 、
、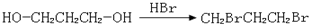 、
、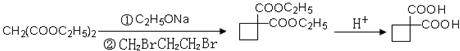 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②>①>③ | B. | ①>②>③ | C. | ③>①>② | D. | ①═②═③ |
查看答案和解析>>
科目: 来源: 题型:解答题
 如图为Fe(OH)2制备实验的改进装置,使用该装置将能在较长时间内观察到白色絮状沉淀.请回答下列问题:
如图为Fe(OH)2制备实验的改进装置,使用该装置将能在较长时间内观察到白色絮状沉淀.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
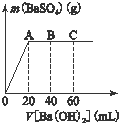 在常温下,某水溶液M中.
在常温下,某水溶液M中.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(B+)=c(A-)>c(OH-)>c(H+) | B. | c(A-)>c(B+)>c(H+)>c(OH-) | ||
| C. | c(B+)+c(H+)=c(A-)+c(OH-) | D. | c(B+)>c(A-)>c(H+)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:解答题
 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应I和II来制备甲醇.| 实验编号 | T(℃) | n(CO)/n(H2) | p(MPa) |
| l | 150 | 1/3 | 0.1 |
| 2 | n | 1/3 | 5 |
| 3 | 350 | m | 5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com