
科目: 来源: 题型:阅读理解
 (2011?天河区一模)某铁矿石样品除含SiO2外,还含有FeO、Fe2O3中的一种或两种,某同学对铁的氧化物的成分进行探究.
(2011?天河区一模)某铁矿石样品除含SiO2外,还含有FeO、Fe2O3中的一种或两种,某同学对铁的氧化物的成分进行探究.查看答案和解析>>
科目: 来源: 题型:
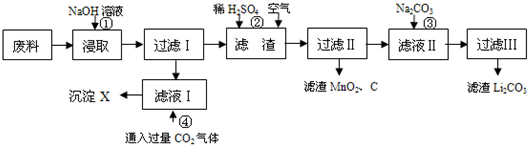
查看答案和解析>>
科目: 来源: 题型:阅读理解
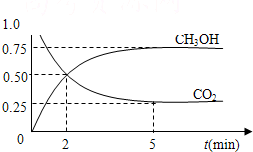 (2011?天河区一模)如何降低大气中CO2的含量及有效地开发利用CO2,已受到各国的普遍重视.
(2011?天河区一模)如何降低大气中CO2的含量及有效地开发利用CO2,已受到各国的普遍重视.| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH- Ca2+(aq)+CO32-(aq),加入在碳酸钙饱和溶液中滴加饱和碳酸钠溶液,溶液中c(CO32-)增大,平衡向逆方向移动
Ca2+(aq)+CO32-(aq),加入在碳酸钙饱和溶液中滴加饱和碳酸钠溶液,溶液中c(CO32-)增大,平衡向逆方向移动 Ca2+(aq)+CO32-(aq),加入在碳酸钙饱和溶液中滴加饱和碳酸钠溶液,溶液中c(CO32-)增大,平衡向逆方向移动
Ca2+(aq)+CO32-(aq),加入在碳酸钙饱和溶液中滴加饱和碳酸钠溶液,溶液中c(CO32-)增大,平衡向逆方向移动查看答案和解析>>
科目: 来源: 题型:
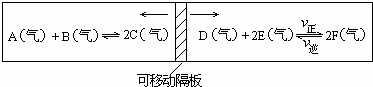
查看答案和解析>>
科目: 来源: 题型:
| 10 |
| 7 |
| 10 |
| 7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com