
科目: 来源: 题型:解答题
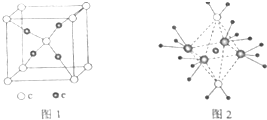 周期表前四周期的元素a、b、c、d、e,原子序数依次增大.A的核外电子总数与其电子层数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同主族,e的最外层只有1个电子,但次外层有18个电子.回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大.A的核外电子总数与其电子层数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同主族,e的最外层只有1个电子,但次外层有18个电子.回答下列问题: .
.查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
| 时间/浓度 | c(CO)(mol/L) | c(H2)(mol/L) | c(CH3OH)(mol/L) |
| 起始 | 0.200 | 0.300 | 0.000 |
| 第4min | a | b | c |

查看答案和解析>>
科目: 来源: 题型:填空题
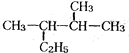
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 由乙烯与氧气在Ag作催化剂下反应制取环氧乙烷原子利用率可达100% | |
| B. | 高聚物的相对分子质量一定为单体相对分子质量的整数倍 | |
| C. |  分子中只存在羧基、羟基两种官能团 分子中只存在羧基、羟基两种官能团 | |
| D. |  分子中至少有14个原子共平面 分子中至少有14个原子共平面 |
查看答案和解析>>
科目: 来源: 题型:解答题

 可简写为
可简写为 ,
, C6H12
C6H12 C7H10.
C7H10.查看答案和解析>>
科目: 来源: 题型:多选题
 如图是可逆反应X2+3Y2?2Z2 在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述正确的是( )
如图是可逆反应X2+3Y2?2Z2 在反应过程中的反应速率(V)与时间(t)的关系曲线,下列叙述正确的是( )| A. | t1时,正反应速率小于逆反应速率 | B. | t2时,正反应速率等于逆反应速率 | ||
| C. | t2-t3,该可逆反应不再发生 | D. | t2-t3,各物质的浓度不再发生变化 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 加入Na2SO4溶液 | B. | 不用稀硫酸,改用98%浓硫酸 | ||
| C. | 滴加少量CuSO4溶液 | D. | 不用铁片,改用铁粉 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 石墨比金刚石稳定 | |
| B. | 金刚石比石墨稳定 | |
| C. | 1mol石墨比1 mol金刚石的总能量高 | |
| D. | 1mol石墨比1 mol金刚石的总能量低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com