
科目: 来源: 题型:选择题
| A. | 硫化亚铁溶于稀硝酸中:FeS+2 H+═Fe2++H2S↑ | |
| B. | NH4HCO3溶于过量NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | 少量二氧化碳通入苯酚钠溶液中:C6H5O-+CO2+H2O═C6H5OH+CO32- | |
| D. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目: 来源: 题型:填空题
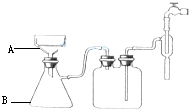 按要求完成硝酸钾晶体的制备实验:
按要求完成硝酸钾晶体的制备实验:| 步骤 | 操作 | 具体操作步骤 | 现象解释结论等 |
① | 溶解 | 取20克KNO3和17克NaCl溶解在35ml水中,加热至沸,并不断搅拌. | 固体溶解 |
| ② | 蒸发 | 继续加热搅拌,使溶液蒸发浓缩. | 有a晶体析出. |
| ③ | 热过滤 | 当溶液体积减少到约原来的一半时,迅速趁热过滤 | 滤液中的最主要成分为b. |
| ④ | 冷却 | 将滤液冷却至室温. | 有晶体析出. |
| ⑤ | 按有关要求进行操作 | 得到初产品硝酸钾晶体 | |
⑥ | 将得到的初产品硝酸钾晶体溶于适量的水中,加热、搅拌,待全部溶解后停止加热,使溶液冷却至室温后抽滤. | 得到纯度较高的硝酸钾晶体 | |
| ⑦ | 检验 | 分别取⑤、⑥得到的产品,配置成溶液后分别加入1滴1mol/l的HNO3和2滴0.1mol/l的AgNO3 | 可观察到⑤、⑥产品中出现的现象分别是⑤产品中产生白色沉淀,⑥产品中无明显现象. |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
 在密闭容器中,对于可逆反应2A+3B?2C(g) 平衡时C的体积分数与温度和压强的关系如图所示,下列说法不正确的是( )
在密闭容器中,对于可逆反应2A+3B?2C(g) 平衡时C的体积分数与温度和压强的关系如图所示,下列说法不正确的是( )| A. | 若正反应方向△H<0,则T2<T1 | |
| B. | 压强增大时,混合气体的平均相对分子质量增大 | |
| C. | A不一定为气体 | |
| D. | B一定为气体 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4+、AlO2-、Cl-、Na+ | B. | K+、Fe2+、Cl-、NO3- | ||
| C. | Na+、SO 42-、Cl-、Al3+ | D. | Na+、NO3-、K+、SO42- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 滴定终点时俯视读数 | |
| B. | 滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了 | |
| C. | 锥形瓶未用待测液润洗 | |
| D. | 滴定前,滴定管中的溶液液面最低点未定在“0”点 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | HCl和HNO3放出H2一样多 | B. | 醋酸中放出H2最多 | ||
| C. | HCl中放出H2最多 | D. | HNO3比醋酸放出H2多 |
查看答案和解析>>
科目: 来源: 题型:填空题
 的一氯取代物有5种
的一氯取代物有5种 发生加聚反应所得产物的结构简式为
发生加聚反应所得产物的结构简式为 .
.
 在上述类似条件下发生反应,请模仿上例写出该反应的方程式:
在上述类似条件下发生反应,请模仿上例写出该反应的方程式: .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②④ | B. | ②③ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,22.4L CHCl3含有的分子数为NA | |
| B. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | |
| C. | 1molFe2+与足量的H2O2溶液反应,转移2NA个电子 | |
| D. | 0.1mol/L的NH4NO3溶液中含有的氮原子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com