
科目: 来源: 题型:填空题
| 元素 | 元素性质或原子结构 |
| A | 周期表中原子半径最小的元素 |
| B | 原子核外有三种不同的能级且各个能级所填充的电子数相同 |
| C | 最外层P轨道半充满 |
| D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
| E | 位于ds区且原子的最外层电子数与A的相同 |
查看答案和解析>>
科目: 来源: 题型:填空题
| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
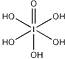 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4.(填“>”、“<”或“=”)查看答案和解析>>
科目: 来源: 题型:填空题
 ;
;查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 学生甲 | 学生乙 |
| A | 向碳酸氢钠溶液中逐渐加入盐酸 | 向盐酸中逐滴加入碳酸氢钠溶液 |
| B | 向氯化亚铁溶液中滴加KSCN溶液,再通入氯气 | 向氯化亚铁溶液中通入氯气,再滴加KSCN溶液 |
| C | 向FeBr2溶液中通入少量Cl2 | 向FeBr2溶液中通入足量Cl2 |
| D | 向BaCl2溶液中通入二氧化硫 | 向BaCl2溶液中通入SO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
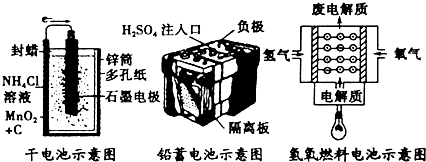
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用A表示的反应速率是0.4mol•L-1•min-1 | |
| B. | 分别用B、C、D表示反应的速率,其比值是1:2:3 | |
| C. | 2min末的反应速率v(B)=0.3mol•L-1•min-1 | |
| D. | 在这2min内用B和C表示的正反应速率的值都是逐渐减小的 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 元素周期表有7个横行,每一个横行是一周期 | |
| B. | 元素周期表有18个纵行,每一个纵行是一族 | |
| C. | 第ⅡA族元素全部是金属元素 | |
| D. | 第ⅦA族元素全部是非金属元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com