
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
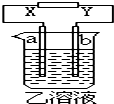 如图所示,X、Y分别是直流电源的两极,通电后发生a极板质量增加,b极板处有无色无味气体放出.符合这一情况的( )
如图所示,X、Y分别是直流电源的两极,通电后发生a极板质量增加,b极板处有无色无味气体放出.符合这一情况的( )| a极板 | b极板 | X电极 | 乙溶液 | |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 正极 | AgNO3 |
| D | 铜 | 石墨 | 负极 | Cu(NO3)2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 依据能否电离出H+,可将化合物分为酸等 | |
| B. | 依据反应是否有离子参加或生成,可将化学反应分为离子反应和非离子反应 | |
| C. | 依据分散质粒子直径的大小,将分散剂为液体的分散系分为溶液、胶体、浊液 | |
| D. | 依据组成元素的种类,将纯净物分为单质和化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com