
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| B | 证明与苯环相连的甲基易被氧化 | 向2mL甲苯中加入3滴酸性KMnO4溶液,振荡;向2mL苯中加入3滴酸性KMnO4溶液,振荡,观察现象 |
| C | 比较HB和HA的酸性强弱 | 取等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体,观察收集到的气体哪个多 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,观察现象 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
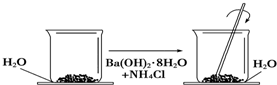
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 减少钢铁中的含碳量,可以增强钢铁的耐腐蚀能力 | |
| B. | 纯银打造的饰品放置一段时间后表面会生成一层黑色物质 | |
| C. | 为保护海轮的船壳,常在船壳上镶入锌块 | |
| D. | 镀银的铁制品,镀层部分受损后,露出的铁表面更易被腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com