
科目: 来源: 题型:选择题
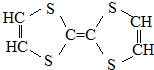
| A. | 它属于烃的衍生物 | B. | 所有的碳杂化方式相同 | ||
| C. | 属于高分子化合物 | D. | 它可以与氢气加成 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 它可以使溴的四氯化碳溶液褪色 | B. | 它可以使酸性高锰酸钾溶液褪色 | ||
| C. | 它与醋酸属于同系物 | D. | 它可与金属钠反应 |
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下11.2L CO2和0.5 molCO2 | |
| B. | 18 mL H2O和2x10Pa,27C 16gO2 | |
| C. | 1 molCO和88gCO2 | |
| D. | 27℃,22.4 LCl2和含4mol氧原子的H2SO4 |
查看答案和解析>>
科目: 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目: 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目: 来源: 题型:解答题
 某学生在实验室分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液用如图所示装置进行测定中和热的实验,并将实验数据记录如下:
某学生在实验室分别取50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液用如图所示装置进行测定中和热的实验,并将实验数据记录如下:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目: 来源: 题型:解答题
 依据叙述,写出下列反应的热化学方程式.
依据叙述,写出下列反应的热化学方程式.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com