
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 ,它的化学键属于极性键;含有离子键和共价键的化合物的化学式为Na2O2.
,它的化学键属于极性键;含有离子键和共价键的化合物的化学式为Na2O2. .
.查看答案和解析>>
科目: 来源: 题型:解答题
 、
、 .
. .
. 、
、 .
. 、
、
 ,如果要合成
,如果要合成 所用的原始原料可以是AC
所用的原始原料可以是AC查看答案和解析>>
科目: 来源: 题型:解答题
 如图是一个化学过程的示意图.已知甲池的总反应式为:
如图是一个化学过程的示意图.已知甲池的总反应式为:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②③⑤ | B. | ①④⑥ | C. | ①③④ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 50mL | B. | 100mL | C. | 250mL | D. | 500mL |
查看答案和解析>>
科目: 来源: 题型:解答题
 中和热是指酸跟碱发生中和反应生成l mol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:
中和热是指酸跟碱发生中和反应生成l mol H2O所放出的热量.某学生想通过测定反应过程中所放出的热量来计算中和热.将50mL0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
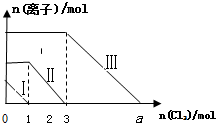 向仅含Fe2+、I-、Br-的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示. (已知氧化性:Br2>Fe3+>I2)请回答下列问题:
向仅含Fe2+、I-、Br-的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示. (已知氧化性:Br2>Fe3+>I2)请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
 有氯化铝和氯化镁的混合溶液,向其中滴加a mL 3mol•L-1 NaOH溶液之后,改成滴加cmol/L HCl溶液,所得沉淀的物质的量y(mol)与试剂总体积V(mL)间的关系如图所示.请回答下列问题:
有氯化铝和氯化镁的混合溶液,向其中滴加a mL 3mol•L-1 NaOH溶液之后,改成滴加cmol/L HCl溶液,所得沉淀的物质的量y(mol)与试剂总体积V(mL)间的关系如图所示.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com