
科目: 来源: 题型:选择题
| 选项 | 离子组 | 加入试剂 | 发生反应的离子方程式 |
| A | Fe3+、S2ˉ、Clˉ、Na+ | NaOH溶液 | Fe3++3OHˉ═Fe(OH)3↓ |
| B | H+、Fe2+、SO42ˉ、NO3ˉ | BaCl2溶液 | SO42ˉ+Ba2+═BaSO4↓ |
| C | Na+、Al3+、Clˉ、SO42ˉ | 少量KOH溶液 | Al3++3OHˉ═Al(OH)3↓ |
| D | Na+、K+、ClOˉ、SO42ˉ | 通入少量SO2 | 2ClOˉ+SO2+H2O═2HClO+SO32ˉ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 由甲苯制甲基环己烷、由乙烷制溴乙烷 | |
| B. | 乙烯使溴水褪色、乙炔使酸性高锰酸钾水溶液褪色 | |
| C. | 由乙烯制聚乙烯、由氯乙烯制聚氯乙烯 | |
| D. | 由苯制硝基苯、由溴乙烷制取乙醇 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 烃的组成均符合通式CnH2n+2 | |
| B. | 有机物均不溶于水 | |
| C. | 甲烷在同系物中含碳量最高,是清洁能源 | |
| D. | 甲烷能发生取代反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH3CH2CHO与HCHO | B. | 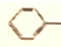 OH与 OH与 CH2OH CH2OH | ||
| C. | 乙酸与HCOOCH3 | D. | CH3CH2Cl与CH3CH2CH2Br |
查看答案和解析>>
科目: 来源: 题型:解答题
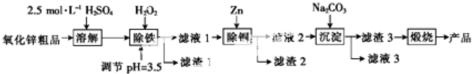
| 离子 | 开始沉 淀的pH | 完全沉 淀的pH |
| Fe2+ | 6.4 | 8.4 |
| Fe3+ | 2.7 | 3.2 |
| Cu2+ | 5.2 | 6.7 |
| Zn2+ | 6.8 | 9.0 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 雷雨时,可增加土壤中硝酸盐类氮肥的含量 | |
| B. | 许多领域中用液氮制得低温环境 | |
| C. | 造成光化学烟雾的罪魁祸首是SO2 | |
| D. | 正常雨水因溶有CO2,其pH约为5.6,而酸雨的pH小于5.6 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
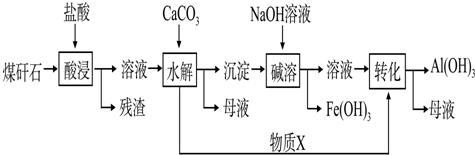
查看答案和解析>>
科目: 来源: 题型:解答题
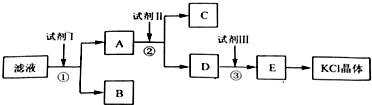
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com