
科目: 来源: 题型:选择题
| A. | 中性溶液中一定是c(H+)=c(OH-)=1×10-7mol/L | |
| B. | 向0.1mol/L的NaOH溶液中加入适量蒸馏水,则c(H+)和c(OH-)均减少 | |
| C. | 25℃时,pH=6的溶液中不可能存在NH3•H2O分子 | |
| D. | 室温下,pH=8的溶液中可能存在CH3COOH分子 |
查看答案和解析>>
科目: 来源: 题型:解答题
 25℃时,电离平衡常数:
25℃时,电离平衡常数:| 弱酸化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数(25℃) | 1.75×10-5 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
查看答案和解析>>
科目: 来源: 题型:解答题
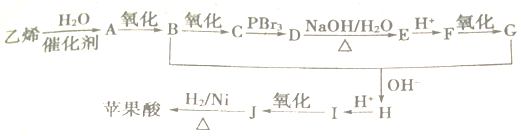
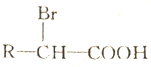
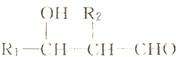
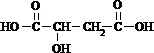 +2NaHCO3→
+2NaHCO3→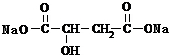 +2CO2↑+2H2O.
+2CO2↑+2H2O. 、
、 .
.查看答案和解析>>
科目: 来源: 题型:解答题

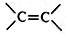 );下列试剂能与甲反应而褪色的是ac(填标号)
);下列试剂能与甲反应而褪色的是ac(填标号) +RCl$\stackrel{AlCl_{3}}{→}$
+RCl$\stackrel{AlCl_{3}}{→}$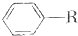 +HCl(-R为烃基)
+HCl(-R为烃基)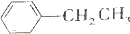 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$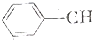 =CH2+H2
=CH2+H2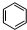 +CH3CH2Cl$→_{△}^{AlCl_{3}}$
+CH3CH2Cl$→_{△}^{AlCl_{3}}$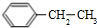 +HCl
+HCl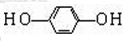 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目: 来源: 题型:选择题
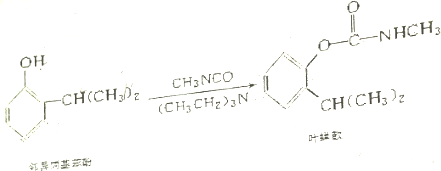
| A. | 叶蝉散的分子式是C11H16NO2 | |
| B. | 叶蝉散分子不能发生氧化反应 | |
| C. | 邻异丙基苯酚的核磁共振氢谱有7个峰 | |
| D. | 邻异丙基苯酚与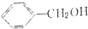 互为同系物 互为同系物 |
查看答案和解析>>
科目: 来源: 题型:解答题
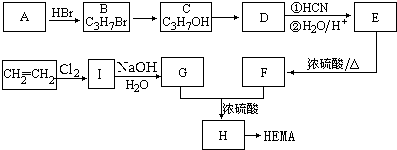
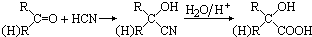
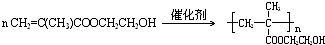 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 发生酯化反应的产物.
发生酯化反应的产物.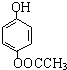 、
、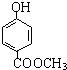 、
、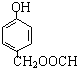 (其中之一).
(其中之一).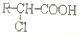

 .
.查看答案和解析>>
科目: 来源: 题型:解答题
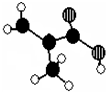
 ,W是否存在顺反异构?否 (填“是”或“否”).
,W是否存在顺反异构?否 (填“是”或“否”).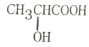 是W与水在一定条件下发生加成反应的产物的同系物.
是W与水在一定条件下发生加成反应的产物的同系物.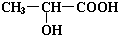 +2Na→
+2Na→ +H2↑.
+H2↑.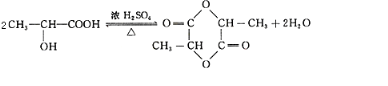 .
.查看答案和解析>>
科目: 来源: 题型:解答题
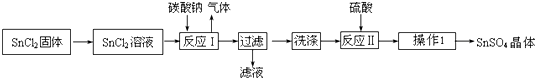
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com