
科目: 来源: 题型:解答题
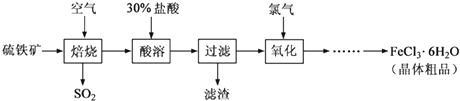
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②⑦ | B. | ①②③⑥ | C. | ①②⑥ | D. | ①②③⑥⑦ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 酸性:HClO4>HBrO4>HIO4 碱性:NaOH>KOH>RbOH | |
| B. | 原子半径:Na>O>F 离子半径:Na+>O2->F- | |
| C. | 稳定性:HF>H2O>H2S 还原性:HCl<H2S<PH3 | |
| D. | 还原性:Na>Mg>Al 氧化性:P>S>Cl2 |
查看答案和解析>>
科目: 来源: 题型:解答题
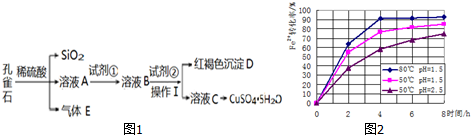
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀时的pH | 2.2 | 7.6 | 4.7 |
| 完全沉淀时的pH | 3.2 | 9.6 | 6.4 |
查看答案和解析>>
科目: 来源: 题型:解答题
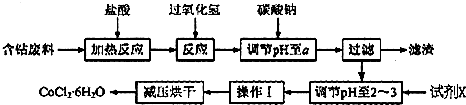
| 沉淀物 | Fe(OH)3 | Co(OH)3 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.2 | 5.2 |
查看答案和解析>>
科目: 来源: 题型:解答题
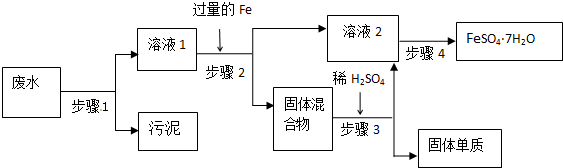
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.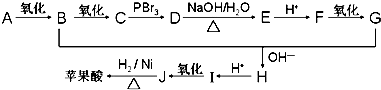
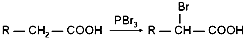
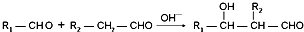
 +n HO-CH2CH2-OH$\stackrel{一定条件}{→}$
+n HO-CH2CH2-OH$\stackrel{一定条件}{→}$ +(2n-1)H2O
+(2n-1)H2O 、
、 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验现象 | 结论 |
| A | 把相同大小的一块铝和镁分别投入相同浓度的NaOH溶液中:铝溶解有气泡放出,而镁没有任何变化 | 由此得出:铝的金属性比镁强 |
| B | 取一块铝箔,用酒精灯点燃:铝箔只熔化成液体而没有脱落 | 由此得出:铝不易燃烧 |
| C | 向氯化铵溶液中投入一铝片:铝片上产生大量气泡 | 由此得出:该气体是氨气 |
| D | 向氯化铝溶液中逐滴滴加NaOH溶液至过量:先产生白色沉淀,后沉淀逐渐溶解,最后沉淀完全消失 | 由此得出:氢氧化铝能溶于强碱溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | Na与稀硫酸反应的离子方程式为2Na+2H+═2Na++H2↑ | |
| B. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 碳酸氢钙溶液中滴加氢氧化钠溶液至Ca2+恰好完全沉淀 Ca2++HCO3-+OHˉ═CaCO3↓+H2O | |
| D. | 饱和碳酸钠溶液中通入过量二氧化碳气体 CO32-+CO2+H2O═HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com