
科目: 来源: 题型:选择题
| A. | 58.5 g的氯化钠固体中含有NA个氯化钠分子 | |
| B. | 0.1 L 3 mo1•L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023 | |
| C. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023 | |
| D. | 4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③④⑥ | B. | ①③⑥ | C. | ③④⑤⑦ | D. | ②④⑥ |
查看答案和解析>>
科目: 来源: 题型:解答题
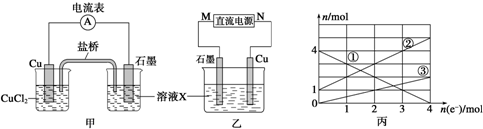
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
 向盐酸和AlCl3的混合溶液中逐滴加入NaOH溶液至过量,生成沉淀Al(OH)3的量随着加入NaOH溶液体积的变化关系如图所示,下列说法正确的是
向盐酸和AlCl3的混合溶液中逐滴加入NaOH溶液至过量,生成沉淀Al(OH)3的量随着加入NaOH溶液体积的变化关系如图所示,下列说法正确的是| A. | 在a点对应的溶液中,加入Mg2+、I-、NH4+、NO3-离子仍能大量共存 | |
| B. | 图中B→C的过程中,实际发生的离子方程式为Al(OH)3+OH-=AlO2-+2H2O | |
| C. | 若b、c的纵坐标数值相同,则横坐标数值之比为1:3 | |
| D. | 原溶液中盐酸和AlCl3物质的量的浓度之比为1:3 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 三种实验方案中都能制得纯净的铜 | |
| B. | 乙方案中加过量铁粉可以将4种阳离子全部还原 | |
| C. | 甲方案中的反应涉及置换、分解、化合、复分解4种反应类型 | |
| D. | 丙方案会产生环境污染 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 室温下$\frac{{K}_{W}}{c({H}^{+})}$=10-13 mol•L-1的溶液中:NH4+、Mg2+、NO3-、SO42- | |
| B. | 含有0.1 mol•L-1 Fe3+的溶液中:K+、Mg2+、SCN-、NO3- | |
| C. | 加入Al能放出H2的溶液中:NH4+、K+、Cl-、HCO3- | |
| D. | 在H+、Na+、SO42-浓度均为0.1 mol•L-1的溶液中:K+、SiO32-、Cl-、CH3COO- |
查看答案和解析>>
科目: 来源: 题型:解答题
 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Z=0.5 mol/L | B. | Z=0.4 mol/L | ||
| C. | Y2=0.5 mol/L或X2=0.1 mol/L | D. | X2=0.2 mol/L或Y2=0.6 mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在放电时,正极发生的反应是Pb(s)+SO42-(ag)-2e-═PbSO4(s) | |
| B. | 在充电时,电池中硫酸的浓度不断变小 | |
| C. | 在充电时,阴极发生的反应是PbSO4(s)+2e-═Pb(s)+SO42-(ag) | |
| D. | 在放电时,该电池的负极材料是氧化铅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com