
科目: 来源: 题型:选择题
| A. | 铜粉溶于FeCl3溶液的离子方程式:Cu+Fe3+=Cu2++Fe2+ | |
| B. | 将Na2O2固体投入H218O中:2H218O+2Na2O2═4OH-+4Na++18O2↑ | |
| C. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓ | |
| D. | Ca(HCO3)2溶液与足量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
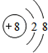 ;
;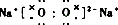 .
.查看答案和解析>>
科目: 来源: 题型:解答题
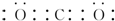
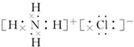

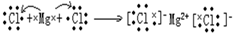 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 铊是易导电的银白色金属 | B. | 能生成+3价离子 | ||
| C. | 氢氧化铊是两性氢氧化物 | D. | Tl3+的氧化能力比Al3+弱 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②④ | B. | ②④⑤ | C. | ①⑤⑥ | D. | ②③⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 5.6g铁粉与足量Cl2反应,失去的电子数为0.2NA | |
| B. | 1.8g重水(D2O)中含有的质子数和电子数均为1.0NA | |
| C. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA | |
| D. | 常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA |
查看答案和解析>>
科目: 来源: 题型:解答题
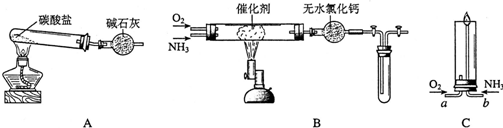
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
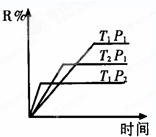 在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2A此反应符合下面图象,(纵坐标为R的质量百分含量)下列叙述正确的是( )
在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2A此反应符合下面图象,(纵坐标为R的质量百分含量)下列叙述正确的是( )| A. | 正反应吸热,A是气体 | B. | 正反应吸热,A是固体 | ||
| C. | 正反应放热,A是气体 | D. | 正反应放热,A是固体或液体 |
查看答案和解析>>
科目: 来源: 题型:填空题
 A、B、C为短周期元素,在周期表中所处位置如图所示,A、C两种元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处位置如图所示,A、C两种元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com