
科目: 来源: 题型:解答题
 某学习小组围绕氯气设计了系列实验.
某学习小组围绕氯气设计了系列实验.| A | B | C | D | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 使用滴定管时,滴定管必须用待装液润洗2~3次 | |
| B. | 酸式滴定管不能盛装碱液,碱式滴定管不能盛装酸液或强氧化性溶液 | |
| C. | 盛装准确量取的待测液的锥形瓶应预先用待测液润洗 | |
| D. | 滴定终点时,若不慎滴入过量标准溶液,可用装有待测液的滴定管再滴入一定量进行调整 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 甲 | 乙 | |
| 所选试剂X | H2O2 | H2O2,少量稀H2SO4 |
| 操作 | 向5mLM和淀粉的混合溶液中加入1mL H2O2 | 向5mLM和淀粉的混合溶液中加入1mL H2O2,再加少量稀H2SO4 |
| 实验现象 | 几秒钟后,溶液呈现很淡的蓝色 | 溶液立刻呈现较深的蓝色 |
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:解答题
 硫酸铜是一种应用极其广泛的化工原料.实验中可将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1所示).
硫酸铜是一种应用极其广泛的化工原料.实验中可将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1所示).查看答案和解析>>
科目: 来源: 题型:解答题
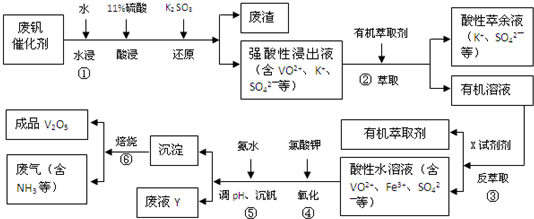
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
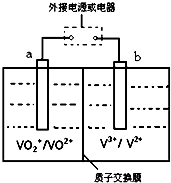
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cu$→_{△}^{H_{2}SO_{4}(浓)}$Cu(NO3)2 | B. | Cu$→_{△}^{空气}$CuO$\stackrel{HNO_{3}(稀)}{→}$Cu(NO3)2 | ||
| C. | Cu$\stackrel{HNO_{3}(稀)}{→}$Cu(NO3)2 | D. | Cu$\stackrel{HNO_{3}(浓)}{→}$Cu(NO3)2 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com