
科目: 来源: 题型:选择题
| A. | 30mL 30mol•L-1 | B. | 25mL 2mol•L-1 | C. | 10mL 1mol•L-1 | D. | 18mL 4mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 砷在通常情况下是固体 | |
| B. | 可以存在-3、+3、+5等多种化合物 | |
| C. | As2O5对应水化物的酸性比H3PO4强 | |
| D. | 砷的气态氢化物比磷的气态氢化物稳定性差 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③④⑤ | B. | ②④⑥⑦ | C. | ③④⑥⑦ | D. | 全部 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②③⑤ | B. | ②③④ | C. | ①②③ | D. | ①③⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH2=CH2+H2$\stackrel{催化剂}{→}$C2H6 | |
| B. | 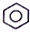 +HNO3$→_{55-60℃}^{浓H_{2}SO_{4}}$ +HNO3$→_{55-60℃}^{浓H_{2}SO_{4}}$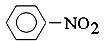 +H2O +H2O | |
| C. | CH3COOCH2CH3+H2O$→_{△}^{稀H_{2}SO_{4}}$CH3COOH+CH3CH2OH | |
| D. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原电池中的电极一定要由两种不同的金属组成 | |
| B. | 电子流出的一极是正极 | |
| C. | 任何化学反应都能设计成原电池 | |
| D. | 原电池中的阳离子向正极移动 |
查看答案和解析>>
科目: 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
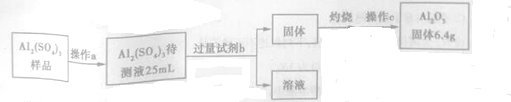
查看答案和解析>>
科目: 来源: 题型:解答题
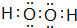 ,含有的化学键为极性键、非极性键(填“极性键”、“非极性键”、“离子键”).
,含有的化学键为极性键、非极性键(填“极性键”、“非极性键”、“离子键”).查看答案和解析>>
科目: 来源: 题型:解答题
 有机物在社会生产、生活中起着非常重要的作用.
有机物在社会生产、生活中起着非常重要的作用.查看答案和解析>>
科目: 来源: 题型:选择题
| 物质 | H2(g) | O2(g) | H2O(g) |
| 1mol分子中的化学键断裂时需要吸收的能量/KJ | 436 | 496 | a |
| A. | 463 | B. | 260 | C. | 926 | D. | 970 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com