
科目: 来源: 题型:选择题
| A. | v(NO)=0.01mol•(L•s)-1 | B. | v(NO)=0.02mol•(L•s)-1 | ||
| C. | v(NH3)=0.1mol•(L•s)-1 | D. | v(NH3)=0.2mol•(L•s)-1 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 矿泉水中含有多种微量元素,经常饮用有益身体健康 | |
| B. | 营养强化剂吃的越多越好 | |
| C. | 合理选择饮食,正确使用药物是人体健康的保证 | |
| D. | 大部分药物都无毒副作用,都是非处方药 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向待测液里加入NaOH溶液,产生红褐色沉淀,则待测液中肯定含有Fe3+ | |
| B. | 向待测液里加入BaCl2溶液,若产生白色沉淀,再加入过量稀硝酸白色沉淀不溶解,则表明待测液中肯定含有SO42- | |
| C. | 向待测液里加入过量硝酸无现象,再加入硝酸银溶液,若无沉淀生成,则表明待测液中肯定不含Cl- | |
| D. | 向待测液里加入CaCl2溶液,不产生白色沉淀,加入稀盐酸产生无色无味气体,该气体通入澄清石灰水中,溶液变浑浊,则表明待测液中肯定含HCO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将二氧化碳气体通入澄清石灰水中:2OH-+CO2=CO32-+H2O | |
| B. | 往碳酸镁中滴加稀盐酸:CO32-+2H+=CO2↑+H2O | |
| C. | 少量金属钠放入冷水中:Na+2H2O=Na++2OH-+H2↑ | |
| D. | 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
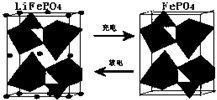
查看答案和解析>>
科目: 来源: 题型:解答题
 利用反应2Fe3++Fe═3Fe2+,设计原电池如图所示.
利用反应2Fe3++Fe═3Fe2+,设计原电池如图所示.查看答案和解析>>
科目: 来源: 题型:解答题
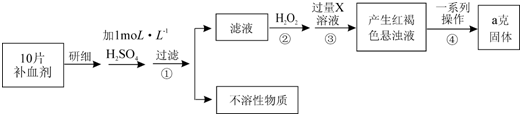
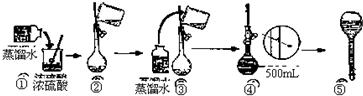
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com